판시사항
[1] 선택발명의 명세서에 있어서 ‘효과’의 기재 정도
[2] 선택발명의 효과가 수개인 경우, 효과 전부에 대하여 명세서 기재요건을 충족해야 하는지 여부(소극)
[3] 선택발명의 효과가 수개인 경우, 진보성을 판단함에 있어 현저성이 인정되는 효과 이외의 나머지 효과도 고려해야 하는지 여부(적극)
[4] 선행발명의 효과가 발명의 목적에 비추어 필요하고도 충분한 효과를 갖춘 경우, 선택발명에 효과의 현저성을 인정할 수 있는지 여부(소극)
[5] 의약의 용도발명인 선행발명의 명세서에 선택발명의 약리효과에 관한 약리데이터 또는 구체적인 실험결과가 기재되어 있는 것은 아니지만 통상의 기술자가 그 용도를 충분히 예측할 수 있으므로 선택발명의 신규성이 부정된다고 한 사례
판결요지
[1] 선택발명의 명세서에 ‘특별하고도 현저한 효과’가 명확하게 기재되었는지 여부는 통상의 기술자가 선행발명과 선택발명을 대비하는 실험을 거치지 아니하고 선행발명과 선택발명의 명세서 기재만을 서로 비교하여 선택발명이 선행발명에 비하여 ‘특별하고도 현저한 효과’가 있음을 알 수 있을 정도로 명확한지 여부로 판단하여야 하는바, 선택발명의 효과가 선행발명의 효과와는 다른 성질의 것이라면(이질적 효과) 그 효과의 내용과 유용성을 기재하는 것(정성적 기재)만으로도 명세서 기재요건을 충족한다고 볼 수 있지만, 동질의 효과를 가지는 경우에는 현저한 양적 차이가 요구되므로 원칙적으로 정량적 기재가 필요하고, 다만 실험대상물을 구체적으로 특정하고 실험방법과 조건을 구체적으로 제시하며 정량적 기재가 없더라도 통상의 기술자가 이러한 기재를 통하여 선행발명의 효과보다 양적으로 현저하게 우수하다는 점을 예측할 수 있다면 효과의 기재가 명확하다고 볼 수 있다.
[2] 선택발명의 효과가 수개인 경우, 선택발명의 진보성은 선행발명의 효과와 대비하여 모든 종류의 효과 면에서 현저한 차이가 있어야 하는 것이 아니라, 선택발명의 효과 중 일부라도 이에 대응하는 선행발명의 효과에 비하여 현저하다고 인정되면 충분하다는 점, 통상의 기술자로서는 선택발명이 목적으로 하는 수개의 효과 중 어느 하나라도 ‘특별하고도 현저한 효과’를 가지면 선행발명 대신에 선택발명을 선택하여 실시할 것이고, 또 다른 효과의 기재가 불명확하다고 하여 선택발명의 실시를 포기하지 않을 것이어서 선택발명의 실시가능성을 충족하는 점, 명세서 기재요건을 갖춘 어느 하나의 효과만으로도 특허를 부여할 가치가 충분하다면 명세서 기재요건을 갖추지 못한 다른 효과까지 주장한다고 하여 발명의 가치가 떨어지는 것이 아니므로 특허를 부여하지 않는 것은 불합리하다는 점, 일반발명에 있어서 구성의 기재가 불명확한 경우에는 발명을 파악하거나 이를 실시하기 불가능하기 때문에 명세서 기재요건의 불비로 특허를 부여하지 않아야 하나, 단지 효과의 기재가 불명확하다고 하여 특허성을 부정하지는 않는 점, 선택발명의 경우 ‘특별하고도 현저한 효과’가 일반발명에 있어서 ‘구성’에 해당하는 것으로서 그 기재의 명확성이 요구되는 것은 발명의 실시가능성과 관련되기 때문이나, 어느 하나의 효과라도 명세서 기재요건 및 효과의 현저성이 충족되는 경우 실시가능성도 충족되며, 이로 인하여 발명이 불명확하게 되는 것은 아니라는 점 등의 모든 사정을 참작하여 보면, 어느 하나의 효과라도 명세서 기재요건을 갖추면 일단 기재불비의 문제는 해소되며, 실제 ‘특별하고도 현저한 효과’가 인정되는지 여부는 진보성 판단의 문제로 취급함이 옳다.
[3] 선택발명의 효과가 수개인 경우, 그 중 어느 하나라도 선행발명의 효과에 비하여 현저하다는 점이 인정되면 선택발명의 진보성을 긍정할 수 있을 것이나, 선택발명을 선행발명에 비하여 ‘특별하고도 현저한 효과’를 가진다고 평가할 수 있기 위해서는 선택발명이 가지는 효과 전체를 종합적으로 고려하여야 하므로, 현저성이 인정되는 효과 이외의 나머지 효과가 선행발명에 비하여 현저히 나쁘다면 선택발명의 효과가 선행발명에 비하여 특별하고도 현저하다고 할 수 없을 것이어서, 나머지 효과는 적어도 선행발명의 효과와 비슷한 정도는 되어야 한다.
[4] 선행발명의 효과가 발명의 목적에 비추어 필요하고도 충분한 효과를 갖춘 경우에는 선택발명의 효과가 아무리 크다 하더라도 진보성 판단에 필요한 효과의 현저성을 인정할 수 없다.
[5] 의약의 용도발명인 선행발명의 명세서에 선택발명의 약리효과에 관한 약리데이터 또는 구체적인 실험결과가 기재되어 있는 것은 아니지만 통상의 기술자가 그 용도를 충분히 예측할 수 있으므로 선택발명의 신규성이 부정된다고 한 사례.
참조조문
[1] 구 특허법(1990. 1. 13. 법률 제4207호로 전문 개정되기 전의 것) 제8조 제3항 (현행 제42조 제3항 참조) [2] 구 특허법(1990. 1. 13. 법률 제4207호로 전문 개정되기 전의 것) 제8조 제3항 (현행 제42조 제3항 참조) [3] 구 특허법(1990. 1. 13. 법률 제4207호로 전문 개정되기 전의 것) 제8조 제3항 (현행 제42조 제3항 참조) [4] 구 특허법(1990. 1. 13. 법률 제4207호로 전문 개정되기 전의 것) 제8조 제3항 (현행 제42조 제3항 참조) [5] 구 특허법(1990. 1. 13. 법률 제4207호로 전문 개정되기 전의 것) 제8조 제3항 (현행 제42조 제3항 참조)
참조판례
【참조판례】 [2] 대법원 2003. 10. 24. 선고 2002후1935 판결 (공2003하, 2268) [5] 대법원 2000. 12. 8. 선고 98후270 판결 (공2001상, 306) 대법원 2003. 12. 26. 선고 2001후2702 판결 대법원 2006. 3. 24. 선고 2004후2307 판결 (공2006상, 747)
원고
사노피-아벤티스 (소송대리인 법무법인 우인 외 4인)
피고
씨제이 주식회사의 소송수계인 씨제이제일제당 주식회사 외 16인 (소송대리인 변리사 안소영 외33인)
피고보조참가인
참제약 주식회사외 3인 (소송대리인 변리사 안소영외 5인)
2007. 12. 21.
주문
1. 원고의 피고 주식회사 엘지생명과학에 대한 소를 각하한다.
2. 원고와 피고 종근당 사이에 특허심판원이 2006. 6. 28. 2004당152호, 2004당2893호(병합), 2005당1253호(병합), 2006당207호(병합), 2006당1097호(병합), 2006당1243호(병합) 사건에 관하여 한 심결 중 (특허등록번호 생략) 발명의 청구범위 제2 내지 5항에 대한 부분을 취소한다.
3. 원고의 피고 주식회사 종근당에 대한 나머지 청구 및 피고 주식회사 종근당, 주식회사 엘지생명과학을 제외한 나머지 피고들에 대한 청구를 모두 기각한다.
4. 소송비용은 보조참가로 인한 비용을 포함하여 모두 원고의 부담으로 한다.
이유
1. 심결의 경위 등
가. 이 사건 특허발명
(1) 발명의 명칭 : 메틸알파-5(4,5,6,7-테트라하이드로(3,2-C)티에노피리딜)(2-클로로페닐)-아세테이트의 우선성 광학이성질체, 그 제법 및 그의 약제학적 조성물
(2) 출원일/등록일/등록번호 : 1988. 2. 16.(우선권 주장일 1987. 2. 17.)/1996. 8. 5./(등록번호 생략)
(3) 특허청구범위
청구항 1. 메틸 α-5(4,5,6,7-테트라하이드로(3, 2-C)티에노피리딜)(2-클로로페닐)-아세테이트의 우선성 광학이성질체 및 약제학적으로 허용되는 그의 염.
{나머지 청구항은 별지 제1항과 같고, 이하 각 청구항의 발명을 ‘이 사건 제1항 발명’의 방식으로 표시하며, ‘메틸 α-5(4,5,6,7-테트라하이드로(3, 2-C)티에노피리딜)(2-클로로페닐)-아세테이트’를 ‘화학식(Ⅰ)’, 화학식(Ⅰ)의 우선성 광학이성질체를 ‘클로피도그렐’이라 한다}
나. 비교대상발명들
비교대상발명 1은 1984. 11. 12. 공개된 간행물인 한국공개특허공보 제84-5448호(갑가 제4·5호증) 및 1985. 7. 16. 공개된 간행물인 미국 특허공보 제4,529,596호(갑가 제6호증)에 각 게재된 ‘티에노 (3,2-c) 피리딘 유도체의 제조방법’에 관한 것이고, 비교대상발명 2(을나 제2호증)는 1977년경 반포된 간행물인 ‘Tetrahedron, Vol 33’에 게재된 ‘라세미체를 분리 또는 분할하여 광학활성 물질을 얻는 방법’에 관한 것이며, 비교대상발명 3은 1985. 8. 16. 공개된 간행물인 일본공개특허공보 소60-156679호(을나 제3호증)에 게재된 ‘벤조티아진 유도체의 제조방법’에 관한 것으로서, 각 그 상세한 설명은 별지 제2항과 같다.
다. 이 사건 심결의 경위와 요지
(1) 원고는 이 사건 특허발명의 권리자이다. 그런데 이 사건 특허발명에 관하여 특허심판원에, 소외 씨제이 주식회사가 2004. 1. 20. 2004당152호 로, 피고 동아제약 주식회사가 2004. 12. 30. 2004당2893호 로, 피고 일양약품 주식회사가 2005. 3. 11. 2005당513호 로, 피고 보령제약 주식회사가 2005. 5. 31. 2005당1253호 로, 피고 건일제약 주식회사가 2006. 4. 28. 2006당1097호 로, 피고 경동제약 주식회사가 2006. 5. 15. 2006당1242호 로, 피고 주식회사 유한양행이 같은 날 2006당1243호 로 각 이 사건 특허발명 전체의 등록무효를, 피고 주식회사 종근당이 2006. 1. 25. 2006당207호 로 이 사건 특허발명 중 제1, 6 내지 11항 각 발명의 등록무효를 각 구하는 심판청구를 하였고, 피고 한미약품 주식회사, 주식회사 엘지생명과학, 주식회사 대웅이 2004당152호 에, 피고 대원제약 주식회사, 동화약품공업 주식회사, 삼성제약 주식회사, 삼진제약 주식회사, 일성신약 주식회사, 코오롱제약 주식회사가 2005당513호 에 각 당사자참가 하였다(이하 피고 및 소외 회사의 명칭 중 ‘주식회사’는 생략한다).
(2) 위 각 심판청구사건의 청구인, 당사자참가인들은 이 사건 특허발명의 등록무효사유로, 신규성 또는 진보성의 흠결(청구항 전부)과 기재불비(청구항 2 내지 5, 8 내지 11)를 주장하였는데, 특허심판원은 위 각 사건을 심리한 후( 2004당2893호 , 2005당1253호 , 2006당207호 , 2006당1097호 , 2006당1243호 각 사건을 2004당152호 사건에 병합하고, 2006당1242호 사건을 2005당513호 사건에 병합하였다), 2006. 6. 28. 및 2006. 8. 29. “이 사건 특허발명의 상세한 설명은 당해 기술분야에서 통상의 지식을 가진 자(이하 ‘통상의 기술자’라 한다)가 별도의 특수한 지식을 부가하지 않더라도 이 사건 특허발명의 내용을 정확하게 이해할 수 있고 동시에 재현할 수 있도록 기재되어 있어 기재불비에 해당하지 않으나, 제1항 내지 제5항, 제10항 및 제11항 각 발명은 비교대상발명 1에 일반식(Ⅰ) 화합물의 ‘각각의 에난티오머’라는 기재가 존재하고, 각각의 에난티오머 및 그를 포함하는 조성물이 청구되어 있으며, 라세미체는 우선성 광학이성질체와 좌선성 광학이성질체의 동량 혼합물이어서, 이 사건 특허발명의 우선성 광학이성질체가 라세미체에 비하여 약리활성 또는 저독성에 있어 2배의 효과를 갖는 것은 통상의 기술자가 예측할 수 있는 정도에 불과하므로, 비교대상발명 1에 비하여 그 신규성이나 진보성이 인정되지 않으며, 제6항 내지 제9항 각 발명은 청구된 제조방법의 최종물질인 우선성 광학이성질체가 특징적 구성요소로 인정될 때에만 특허성이 인정될 수 있으나 우선성 광학이성질체는 비교대상발명 1에 의하여 공지된 것이므로 진보성이 인정되지 않는다.”라는 이유로 피고들의 심판청구를 인용하는 이 사건 각 심결을 하였다.
라. 이 사건 특허발명의 정정
원고는 2006. 9. 5. 이 사건 특허발명의 명세서 중 제3면 제9행, 제13면 제3행, 제17면 제11행, 제19면 제16행의 각 ‘황산염’을 ‘황산수소염’으로, 명세서 제13면 제11행의 ‘ 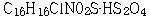 ’를 ‘
’를 ‘ 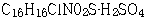 ’로 각 정정하고, 특허청구범위 제3항 ‘메틸 α-5(4,5,6,7-테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐)-아세테이트의 우선성 광학이성질체의 황산염’을 ‘메틸 α-5(4,5,6,7-테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐)-아세테이트의 우선성 광학이성질체의 황산수소염’으로 정정하는 심판청구를 하였는데, 특허심판원은 위 사건을 2006정62호 로 심리한 후, 2007. 9. 28. 원고의 정정심판청구를 인용하는 심결을 하였다.
’로 각 정정하고, 특허청구범위 제3항 ‘메틸 α-5(4,5,6,7-테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐)-아세테이트의 우선성 광학이성질체의 황산염’을 ‘메틸 α-5(4,5,6,7-테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐)-아세테이트의 우선성 광학이성질체의 황산수소염’으로 정정하는 심판청구를 하였는데, 특허심판원은 위 사건을 2006정62호 로 심리한 후, 2007. 9. 28. 원고의 정정심판청구를 인용하는 심결을 하였다.
[증거 : 다툼 없거나 갑가 제1 내지 6호증, 제70호증, 을다 제4호증(각 가지번호 포함)]
2. 원고의 피고 엘지생명과학에 대한 소의 적법 여부에 관한 판단
가. 사실인정
피고 엘지생명과학은 소외 씨제이가 제기한 2004당152호 심판청구사건에 당사자로 참가하여 이 사건 심결을 받은 사실은 앞서 인정한 바와 같고, 기록에 의하면, 피고 엘지생명과학은 이 사건 소가 진행 중이던 2007. 4. 19. 특허심판원에 심판참가취하서를 제출한 사실을 인정할 수 있다.
나. 판 단
위 인정 사실에 의하면, 피고 엘지생명과학은 그 참가신청의 취하로 인하여 2004당152호, 2004당2893호(병합), 2005당1253호(병합), 2006당207호(병합), 2006당1097호(병합), 2006당1243호(병합) 심판청구사건에서 당사자참가인의 지위를 상실하였고, 이에 따라 위 심판청구사건의 심결에 대한 취소소송인 이 사건 소에서의 당사자적격 또한 상실하게 되었으므로, 원고의 피고 엘지생명과학에 대한 소는 부적법하다.
3. 이 사건의 쟁점과 당사자 관계
가. 이 사건의 쟁점
이 사건의 쟁점은, ① 이 사건 제1항 및 제3항 각 발명의 완성 여부 ② 비교대상발명들에 의하여 이 사건 특허발명의 신규성 또는 진보성을 부정할 수 있는지 여부, ③ 이 사건 제1 내지 5항 각 발명에 구 특허법(1990. 1. 13. 법률 제4207호로 전문 개정되기 전의 것, 이하 같다) 제8조 제3항 소정의 기재불비의 위법이 있는지 여부이다.
나. 당사자 관계의 정리
(1) 피고 한미약품, 엘지생명과학, 대웅, 대원제약, 동화약품공업, 삼성제약, 삼진제약, 일성신약, 코오롱제약의 피고적격
원고는 이 사건 각 심결의 심판단계에서 당사자참가를 하였던 한미약품, 엘지생명과학, 대웅, 대원제약, 동화약품공업, 삼성제약, 삼진제약, 일성신약, 코오롱제약을 상대로 이 사건 소를 제기하였는바, 특허법 제187조 는 특허무효심판에 대한 심결취소소송의 피고적격을 “청구인 또는 피청구인”으로 규정하고 있어, 문언상 참가인이 피고적격에서 제외된 듯이 보인다.
그러나 같은 법 제155조 는 당사자참가인은 피참가인이 그 심판의 청구를 취하한 후에도 심판절차를 속행할 수 있고( 제2항 ), 당사자참가인에 대하여 심판절차의 중단 또는 중지의 원인이 있는 때에는 그 중단 또는 중지는 피참가인에 대하여도 그 효력이 발생하는 것으로( 제5항 ) 각 규정하고 있는바, 위와 같이 특허법이 당사자참가인에게는 보조참가인과는 달리 당사자에 준하는 지위를 부여하고 있는 점에 비추어 보면, 특허법 제187조 의 ‘청구인 또는 피청구인’에는 당사자참가인도 포함되는 것으로 해석하여야 한다.
(2) 원고 보조참가신청인
피고 종근당은 2007. 6. 26. 원고의 나머지 피고들에 대한 이 사건 청구 중 이 사건 제3항 발명에 대하여 원고를 보조하기 위한 보조참가신청을 하였고, 이에 대하여 피고 동아제약이 이의신청을 하여, 이 법원은 2007. 9. 5. 보조참가신청인의 보조참가신청을 허가하지 아니하는 결정을 하였다. 그러나 위 결정에 대하여 보조참가신청인이 2007. 9. 11. 대법원 2007흐2 로 항고를 제기하였으나 이 사건 변론이 진행 중이던 2007. 12. 14. 항고기각되어 같은 달 21일 확정되었다.
그런데 행정소송법 제8조 제2항 에 의하여 준용되는 민사소송법 제75조 제1항 은, “참가인은 그의 참가에 대한 이의신청이 있는 경우라도 참가를 허가하지 아니하는 결정이 확정될 때까지 소송행위를 할 수 있다.” 제2항 은 “당사자가 참가인의 소송행위를 원용(원용)한 경우에는 참가를 허가하지 아니하는 결정이 확정되어도 그 소송행위는 효력을 가진다.”라고 각 규정하고 있고, 이 사건의 경우 당사자가 원용하였으므로, 보조참가신청인이 위 보조참가신청 불허가결정이 확정되기 전까지 보조참가인으로서 행한 소송행위는 유효하다.
(3) 당사자들의 입장 정리
이 사건 소송에 있어서 피고들 사이에는, 이 사건 특허발명 전부의 무효를 주장하는 피고 씨제이제일제당, 동아제약, 일양약품, 건일제약, 경동제약, 한미약품, 대웅, 대원제약, 동화약품공업, 삼성제약, 삼진제약, 일성신약, 코오롱제약(이하 ‘피고 가그룹’이라 한다)과 이 사건 제3항 발명 또는 제3 내지 5항 각 발명을 제외한 나머지 청구항의 발명의 무효를 주장하는 피고 보령제약, 종근당, 유한양행, 한미약품(이하 ‘피고 나그룹’이라 한다)으로 나뉘어 있으므로, 이하 특별히 당사자를 구별할 필요가 있을 경우를 제외하고는 ‘원고의 주장’에 원고 보조참가인 및 피고 나그룹의 주장을 포함시키고, ‘피고 가그룹의 주장’에 그 보조참가인의 주장을 포함시켜 표시한다.
4. 선택발명과 그 특허요건
가. 이 사건 특허발명의 성격
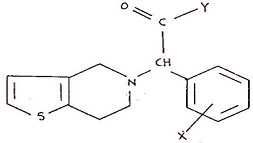
〈 일반식(Ⅰ) 〉
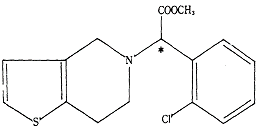
〈 화학식(Ⅰ) 〉
이 사건 특허발명은 클로피도그렐 즉, ‘메틸 α-5(4,5,6,7-테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐)-아세테이트의 우선성 광학이성질체’라는 물질 자체와 그 제법 및 그의 약제학적 조성물에 관한 발명이다. 그런데 이 사건 특허발명의 명세서에 선행기술로 기재되어 있는 비교대상발명 1은 위 일반식(Ⅰ)의 티에노 (3,2-c) 피리딘 유도체의 제조방법에 대한 것으로서, 일반식(Ⅰ)에서 “Y는 OH기 또는 R이 직쇄 또는 분지쇄 저급 알킬기인 OR기이거나 N=R₁R₂이며, 여기서 R₁ 및 R₂ 각각 서로 다른 수소 또는 직쇄나 분지쇄 저급 알킬기이고, R₁과 R₂는 이들이 부착되는 질소와 함께 산소 또는 질소 같은 제2헤테로 원자를 포함할 수 있는 헤테로 사이클을 형성하며, 질소는 치환될 수 있는 저급알킬 또는 벤질기에 의하여 치환될 수 있고, X는 수소, 할로겐 또는 저급알킬기를 나타낸다. 비대칭 탄소를 갖는 이들 화합물들은 두 종의 에난티오머 형태로 존재할 수 있다. 본 발명은 각각의 에난티오머와 이들의 혼합물을 포함한다. 본 발명은 또한, Y가 OR기 또는 N=R₁R₂인 경우 약제학적으로 허용되는 무기 또는 유기산과의 부가염, 또는 Y가 OH인 경우 무기염기와의 부가염을 포함한다. 본 명세서에서 저급 알킬기라 함은 C₁-C₄ 포화 탄화수소 체인을 의미한다.”라고 기재되어 있다(갑가 제5호증, 명세서 제1면 제5행∼ 제2면 제4행).
따라서 다양한 치환기가 정의되어 있는 일반식(Ⅰ)에 포함되는 화합물의 종류는 많은데, 그 중 X가 2-Cl이고, Y가 OCH₃(즉 Y가 OR이고, R이 CH₃인 경우)일 경우 화학식(Ⅰ)의 화합물이 되며, 클로피도그렐도 화학식(Ⅰ)에 해당하는 화합물이다.
한편, 탄소원자에는 4개의 원자단이 결합할 수 있고, 하나의 탄소에 결합된 4개의 원자단이 모두 다를 경우 그 탄소를 부제탄소(불제탄소)라 하는데, 부제탄소 하나를 가지는 화합물은 동일 평면에서 그 배열이 달라 완전히 겹쳐질 수 없는 한 쌍의 에난티오머(enantiomer, 거울상이성체 또는 광학이성질체)를 가질 수 있다. 한 쌍의 에난티오머는 그 분자식이 서로 완전히 동일하므로 분자식에 따른 명명법만으로는 이들을 구분할 수 없기 때문에, ① 나사선상 탄소에 결합된 각각의 원자단을 원자번호가 큰 순서에 따라 우선순위를 매기고, 가장 우선순위가 낮은 원자단을 관측자로부터 가장 멀리 떨어지게 한 다음, 높은 순위로부터 낮은 순으로 추적할 때 추적하는 방향이 시계방향과 같으면 R(rectus) 에난티오머로, 시계반대방향이면 S(sinister) 에난티오머로 명명(명명)하는 방법과, ② 평면편광(plane-polarized light, 빛의 진동은 진행하는 방향에 대해서 직각으로 일어나는데, 보통의 빛은 모든 평면에서 진동하나, 평면편광은 진동이 일어나는 가능한 여러 가지 평면 중에서 오직 한 평면 내에서만 진동이 이루어지는 빛이다)을 광학이성질체에 통과시키면, 빛이 진동하는 평면 즉, 편광면이 회전하게 되는데(빛이 이성질체를 통과하면서 굴절되는 방향으로 회전하게 된다), 시계방향으로 회전하면 우선성{+, d(dextro)} 광학이성질체, 시계반대방향으로 회전하면 좌선성{-, l(levo)} 광학이성질체라고 명명하는 방법이 있다. 그런데 동일한 광학이성질체라도 위 ① 방법에서의 방향과 위 ② 방법에서의 방향이 반드시 일치하는 것은 아니다. 그리고 우선성 에난티오머 및 좌선성 에난티오머의 50:50 혼합물을 라세미체(racemate)라고 하는데, 우선성 또는 좌선성의 표시가 없는 경우 라세미체를 의미한다(다툼 없는 사실 및 변론 전체의 취지).
화학식(Ⅰ)에 해당하는 ‘메틸α-5(4,5,6,7-테트라하이드로(3,2-C)티에노피리딜)(2-클로로페닐)-아세테이트’ 역시 1개의 비대칭 탄소(* 위치)를 갖는 물질이므로, 우선성 광학이성질체와 좌선성 광학이성질체가 존재하는 라세미체이고, 그 중 우선성 광학이성질체(위 ① 명명법에 의하면 S 에난티오머)가 이 사건 특허발명의 클로피도그렐과 동일한 화합물이다.
따라서 이 사건 특허발명의 클로피도그렐은 비교대상발명 1에서 상위개념으로 개시하고 있는 일반식(Ⅰ)의 화합물 중 하나이므로, 이 사건 특허발명은 비교대상발명 1과의 관계에 있어서 이른바 ‘선택발명’에 해당한다.
나. 선택발명의 특허요건
(1) 선택발명의 의의
선택발명이란 선행 또는 공지의 발명에 구성요건이 상위개념으로 기재되어 있고 위 상위개념에 포함되는 하위개념을 구성요건 중의 전부 또는 일부로 하는 발명을 말하는 것인데, 형식적으로는 선행 또는 공지의 발명에 개시된 발명 중 하나를 선택한 것에 불과하여 신규성이 없는 것이거나 선행발명과의 사이에 중복특허의 문제가 생길 수 있다. 그러나 선행발명의 개시를 넓게 허용하여 발명활동을 장려하는 것과 함께 선행 또는 공지의 발명에 구체적으로 개시되어 있지 않은 유익한 발명에 특허권을 부여함으로써 산업의 발달과 공익의 증진을 꾀할 수 있으므로, 일정한 요건을 갖춘 선택발명에 대하여는 특허성을 부여하는 것이 미국, 일본 등 세계적인 추세이고, 우리나라 역시 심사실무와 판례에서 선택발명을 인정하고 있다.
(2) 선택발명의 특허성
선택발명은 첫째, 선행발명이 선택발명을 구성하는 하위개념을 구체적으로 개시하지 않고 있으면서 둘째, 선택발명에 포함되는 하위개념들 모두가 선행발명이 갖는 효과와 질적으로 다른 효과가 있거나, 질적인 차이가 없더라도 양적으로 현저한 차이가 있는 경우에 한하여 특허를 받을 수 있다( 대법원 2003. 4. 25. 선고 2001후2740 판결 , 대법원 2003. 10. 10. 선고 2002후2846 판결 , 대법원 2006. 11. 24. 선고 2003후2089 판결 , 대법원 2007. 9. 6. 선고 2005후3338 판결 등 참조).
위 첫째 요건은 선택발명의 신규성 문제이고, 뒤 둘째 요건은 선택발명의 진보성 문제이므로, 선택발명이 선행발명에 구체적으로 개시되어 있는 것이라면, 비록 선행발명의 명세서에 명시적으로 기재되어 있거나 이로부터 통상의 기술자가 예측할 수 있는 효과에 비하여 현저하게 이질적이거나 양적으로 우수하여 유용성이 크다 하더라도, 이질적 효과를 기초로 한 별도의 용도발명이 성립하지 않는 한 특허가 부여될 수 없는바, 이는 이러한 발명이 이미 공지된 발명에 대한 단순한 효과의 확인에 지나지 않는 것이어서 산업발전에 기여하는 정도가 미미하기 때문이다.
5. 명세서 기재요건에 관한 판단
가. 당사자의 주장
(1) 원고 주장의 요지
(가) 이 사건 특허발명의 명세서에는 이 사건 제1항 내지 제5항 각 발명의 약리활성 및 독성 측면에서의 효과가 명확하게 기재되어 있음은 물론, 비교대상발명 1의 라세미체와의 대비결과가 정량적인 데이터로 기재되어 있으므로, 선택발명의 명세서 기재요건을 충족한다.
(나) 이 사건 제3항 내지 제5항 각 발명은 비교대상발명 1의 라세미체에 비하여 약리활성 및 독성의 측면에서 우수한 효과를 가지면서, 이에 더하여 결정 형성성, 수용성, 비흡습성과 같은 제제학적 성질(제제학적 성질)의 측면에서도 우수한 효과를 가지는데, 제제학적 효과에 대하여 발명의 상세한 설명에 “쉽게 결정화되고 흡습성을 갖지 않으며 특히 유리한 활성 의약품으로 사용될 수 있는 수용성 염”이라고 명확히 기재되어 있다.
(다) 비교대상발명 1에는 이 사건 특허발명 명세서에 기재되어 있는 제제학적 효과에 관하여 아무런 기재가 없고 이에 대한 인식도 없으므로, 비교대상발명 1의 혈소판 응집 저해 효과와는 성격이 다른 이질적인 효과이다. 따라서 선택발명으로서의 명세서 기재 정도는 효과의 성질을 명확히 기재하는 정성적 기재로 충분하다.
(2) 피고 가그룹 주장의 요지
(가) 이 사건 특허발명의 명세서에는 이 사건 제1항 발명의 효과와 관련하여 비교대상발명 1이 가지는 약리효과 및 저독성 효과가 기재되어 있으나, 이로부터는 이 사건 제1항 발명이 비교대상발명과 비슷한 효과가 있음을 알 수 있을 뿐이고 ‘양적으로 현저함’을 전혀 알 수 없으므로, 선택발명으로서의 효과 기재가 명확하다고 볼 수 없다.
(나) 비교대상발명 1도 일반식(Ⅰ)에 해당하는 화합물들을 생성하여 오일상 물질을 얻은 경우 이를 다시 정제하여 결정성 염을 형성하였고, 결정성 염은 제제학적으로 결정성, 수용성, 비흡습성을 당연히 가지므로, 이 사건 제2항 내지 제5항 각 발명이 가지는 제제학적 효과는 비교대상발명 1과 동질의 효과다. 그런데 이 사건 특허발명의 명세서에는 제제학적 효과와 관련하여 일반적으로 결정성 염이 가지는 효과 정도만 기재되어 있을 뿐, 양적으로 현저한 효과에 대하여 기재되어 있지 않으므로 명세서 기재요건을 충족하지 못하였다.
(다) 선택발명으로서의 명세서 기재요건은 선택발명의 효과 전부에 대하여 충족되어야 하므로, 이 사건 특허발명의 명세서에는 약리효과뿐만 아니라 제제학적 효과 모두에 대해 효과의 현저성이 명확하게 기재되어야 한다.
나. 학설과 판례의 정리
(1) 학 설
(가) 정량적 기재(정량적 기재)를 요구하는 견해
선택발명자는 선행발명에 비하여 이질적인 효과를 가지는 선택발명의 경우에는 그 이질적인 효과의 구체적 내용을 명세서에 기재하고, 동질이면서 현저한 효과를 가지는 선택발명의 경우에는 선행발명에 비하여 우수한 효과를 객관적으로 인식할 수 있는 적어도 하나의 구체적 대비결과를 명세서에 제시함으로써, 자신이 선택발명의 출원 당시에 실제로 발명의 완성에 이르렀음을 통상의 기술자가 알 수 있도록 해야 한다는 입장이다. 이러한 입장은 특히 동질의 효과에 있어서 정량적 기재가 있어야 선택발명이 선행발명에 비하여 현저히 우수하다는 점을 잘 알 수 있다는 것을 논거로 한다.
(나) 정성적 기재(정성적 기재)로 충분하다는 견해
명세서 중에 발명자가 인식한 효과의 기재가 있으면 충분하고 효과의 현저함은 추후의 실험자료로 입증이 가능하다는 입장이다. 우리 특허법은 미국 등 다른 나라의 제도와는 달리 출원인에게 선행기술의 개시의무를 엄격하게 지우고 있지 아니하므로, 발명자가 출원 당시에 출원발명이 선택발명에 해당하는지 여부를 알기 어려울 뿐만 아니라 이를 요구할 근거가 없고, 선택발명에 해당하는지 여부는 사후에 발명의 진보성 등을 판단하는 단계에서 선행발명과의 대비를 통해 밝혀지는 경우가 많은데, 최초 출원 당시에 선택발명으로서의 현저한 효과까지 발명의 상세한 설명에 기재할 것을 요구하는 것은 발명자에게 가혹하다는 것을 논거로 한다.
(다) 절충설
선행발명의 발명자와 선택발명의 발명자가 동일인이거나 선택발명의 명세서에 그 선택발명이 선행발명을 전제로 하고 있는 사정이 나타나 있는 경우에는 정량적 기재가 필요하나, 그렇지 않은 경우에는 선택발명의 기술적 사상이 아닌 일반적인 발명의 기술적 사상에 의해 출원한 것이므로, 출원인은 자신이 완성한 발명의 범위 내에서 제3자가 이해하고 반복·재현할 수 있을 정도로 기재하면 족하고, 선택발명에 필요한 명세서 기재요건까지 갖추어야 하는 것은 아니라는 입장이다. 전자의 경우에는 발명자는 출원 당시 선행발명에 비하여 선택발명이 양적으로 현저히 우수한 점을 명확히 인식하고 발명을 완성하였고, 위와 같은 인식에 근거가 되는 자료를 반드시 가지고 있을 것이므로 이를 정량적인 수치로 표시하여 명세서에 기재할 수 있을 것이라는 점을 논거로 한다.
(2) 판 례
선택발명의 진보성 판단에 있어서, “선행 또는 공지의 발명에 구성요건이 상위개념으로 기재되어 있고 위 상위개념에 포함되는 하위개념만을 구성요건 중의 전부 또는 일부로 하는 이른바 선택발명은 첫째, 선행발명이 선택발명을 구성하는 하위개념을 구체적으로 개시하지 않고 있으면서 둘째, 선택발명에 포함되는 하위개념들 모두가 선행발명이 갖는 효과와 질적으로 다른 효과를 갖고 있거나, 질적인 차이가 없더라도 양적으로 현저한 차이가 있는 경우에 한하여 특허를 받을 수 있고, 이 때 선택발명의 상세한 설명에는 선행발명에 비하여 위와 같은 효과가 있음을 명확히 기재하면 충분하고, 그 효과의 현저함을 구체적으로 확인할 수 있는 비교실험자료까지 기재하여야 하는 것은 아니며, 만일 그 효과가 의심스러울 때에는 출원일 이후에 출원인이 구체적인 비교실험자료를 제출하는 등의 방법에 의하여 그 효과를 구체적으로 주장·입증하면 된다.”고 판시하였다.
선택발명의 기재불비에 관하여, “선행 또는 공지의 발명에 구성요건이 상위개념으로 기재되어 있고 위 상위개념에 포함되는 하위개념만을 구성요건 중의 전부 또는 일부로 하는 이른바 선택발명은 선행발명이 선택발명을 구성하는 하위개념을 구체적으로 개시하지 아니하고, 선택발명에 포함되는 하위개념들 모두가 선행발명이 갖는 효과와 질적으로 다른 효과를 갖고 있거나, 질적인 차이가 없더라도 양적으로 현저한 차이가 있는 경우에 한하여 특허를 받을 수 있고, 선택발명의 상세한 설명에 그와 같은 효과가 있음을 구체적으로 확인할 수 있는 비교실험자료 또는 대비결과까지 기재하여야 하는 것은 아니라고 하더라도 통상의 기술자가 선택발명으로서의 효과를 이해할 수 있을 정도로 명확하고 충분하게 기재하여야 명세서 기재요건이 구비되었다고 할 수 있다.”라고 판시하고 있다.
다. 판단 기준
(1) 선택발명에 있어서 효과 기재의 성격과 명확성의 필요
앞서 살펴본 바와 같이, 선택발명은 선행발명이 미처 인식하지 못한 특별하고도 현저한 효과를 발견한 것에 특허성을 부여하는 근거가 있으므로, 선택발명에 있어서의 ‘효과’는 일반 발명에서의 ‘효과’와는 달리 발명의 핵심을 이루는 ‘구성’의 성격을 가지는 것이다. 따라서 효과에 대한 명세서의 기재 정도에 있어서도 일반 발명의 효과 기재 정도로는 부족하고, 일반 발명에 있어서 ‘구성의 명확한 기재’ 정도로 엄격할 필요가 있다. 선택발명의 발명자는 발명의 출원시에 ‘특별하고도 현저한 효과’를 인식하였어야 발명이 완성되었다고 볼 수 있는데, 사후에 실시한 실험결과에 의하여 비로소 ‘특별하고도 현저한 효과’가 드러난다면 미완성 발명을 사후에 완성하는 결과가 되고, 출원시에 이미 발명자가 ‘특별하고도 현저한 효과’를 인식하고 있었는지 여부는 명세서를 통해 확인할 수밖에 없기 때문이다.
그리고 발명에 대하여 특허를 부여하는 것은 발명의 기술내용을 제3자에게 공개한 것에 대한 대가이며, 발명의 명세서는 이러한 기술공개의 역할을 하는 기술문헌으로서의 의미도 있으므로, 통상의 기술자가 발명의 상세한 설명을 보고 발명을 용이하게 실시할 수 있어야 한다. 이 사건 특허발명과 같은 화학물질의 발명에 있어서 발명의 대상인 화학물질의 구성은 화학식으로 표현되고, 명세서에 화학식이 명확하게 기재되어 있으며, 이를 재현하는 데 기술적 어려움이 있는 특별한 사정이 없는 한, 통상의 기술자가 화학물질 자체를 생산하는 데에는 문제가 없을 것이다. 그러나 제3자가 선행발명에 구체적으로 개시된 화학물질 대신에 선택발명을 선택하여 실시하는 것은 선택발명이 선행발명에 비하여 가지는 ‘특별하고도 현저한 효과’ 때문이므로, 이러한 효과가 명세서에 명확하게 기재되어 있지 않다면 제3자가 선택발명의 가치와 의의를 알 수 없어 굳이 선행발명을 두고 선택발명을 실시하지 않을 것이고, 따라서 구 특허법 제8조 제3항 에서 요구하는 통상의 기술자가 발명을 ‘용이하게 실시할 수 있을 정도’에 이르지 못하게 된다.
위와 같이 선택발명에 있어서 효과의 기재를 엄격하게 요구하는 것은, 특허법이 규정하고 있는 발명의 카테고리 내지 범주(물건의 발명, 물건을 생산하는 방법의 발명, 방법의 발명)에는 속하지 아니하지만, 가치 있는 범위나 용도를 발견한 것을 근거로 특허를 부여하는 수치한정 발명이나 의약의 용도발명에서 있어서 발명의 상세한 설명에 엄격한 효과의 기재를 요구하는 것( 대법원 2004. 12. 23. 선고 2003후1550 판결 , 대법원 2005. 4. 15. 선고 2004후448 판결 등 참조)과의 균형을 고려하더라도 합리적인 것이다.
따라서 선택발명의 명세서에 ‘특별하고도 현저한 효과’가 명확하게 기재되었는지 여부는 통상의 기술자가 선행발명과 선택발명을 대비하는 실험(선택발명에 있어서는 이러한 실험은 ‘발명’에 준하는 것이다)을 거치지 아니하고 선행발명(명세서 또는 문헌 등 선행발명을 인식할 수 있는 자료)과 선택발명의 명세서 기재만을 서로 비교하여 선택발명이 선행발명에 비하여 ‘특별하고도 현저한 효과’가 있음을 알 수 있을 정도로 명확한지 여부로 판단하여야 한다. 왜냐하면, 선택발명의 명세서 자체만으로 선행발명과의 현저한 효과 차이를 알 수 있어야 발명자가 선택발명으로서의 가치를 인식하고 발명을 완성하였는지 여부와 통상의 기술자가 명세서를 통하여 선택발명의 가치를 인식하고 이를 실시할 수 있을 것인지를 확인할 수 있기 때문이다.
선택발명의 효과가 선행발명의 효과와는 다른 성질의 것이라면(이질적 효과) 그 효과의 내용과 유용성을 기재하는 것(정성적 기재)만으로도 선택발명의 ‘특별하고도 현저한 효과’를 인식할 수 있으므로 명세서 기재요건을 충족한다고 볼 수 있다. 그러나 동질의 효과를 가지는 경우에 과연 어느 정도까지 기재하여야 명확한 것으로 볼 수 있는지에 관해서는 여러 문제가 있으므로, 아래에서 살펴본다.
(2) 대비결과 기재의 필요성
선행발명에 비하여 선택발명이 양적으로 현저한 효과를 가진다는 것은 양자를 대비한 결과가 선택발명의 명세서에 기재되어 있으면 아주 쉽게 알 수 있을 것이나(가장 바람직한 기재방법이다), 선택발명의 출원 후라도 통상의 기술자가 선행발명과 선택발명의 명세서 대비를 통해 동질 효과의 현저성을 명확하게 알 수 있으면 충분하고, 굳이 선택발명의 발명자가 출원 당시에 선행발명을 인식하고 있어야 하는 것은 아니므로, 위 나.(2)항에서 살펴본 대법원의 판시와 같이, 선택발명과 선행발명의 대비결과가 선택발명의 명세서에 반드시 기재되어야 할 필요는 없다. 따라서 선택발명의 발명자가 선행발명의 발명자와 동일인이거나 선택발명의 명세서에 그 선택발명이 선행발명을 전제로 하고 있는 사정이 나타나 있는 경우와 그렇지 않은 경우를 구별하여 명세서 기재요건을 달리 취급할 필요도 없다.
그리고 양 발명의 대비결과를 기재하는 경우에도 반드시 실험결과에 기초하여 정확한 수치를 기재할 필요는 없고, 선행발명에 비하여 약 몇 배 정도의 효과가 있다는 식으로 기재한 것이라도 해당 효과에 있어서 선택발명의 현저성을 인식할 수 있으면 명확한 기재라고 볼 수 있다.
(3) 정량적 기재의 필요성
이질적 효과와는 달리 동질의 효과에 있어서의 특별 현저성은 양 발명의 효과의 양적 차이가 현저한지 여부에 의하여 결정되고, 양적 차이는 결국, 정량적 수치를 서로 대비하는 것으로 확인할 수밖에 없다. 따라서 선택발명의 효과에 대한 정성적 기재만 있고 정량적 기재가 없다면 선행발명의 효과와의 양적 차이를 알기 어렵기 때문에 동질의 효과에 있어서는 원칙적으로 정량적 기재가 필요하다.
위 나.(2)항에서 살펴본 대법원의 판결들도 선택발명과 선행발명의 ‘대비결과’까지 필요한 것은 아니라고 한 것이지, 선택발명의 효과에 대한 정량적 수치의 기재가 전혀 필요없고 항상 정성적 기재만으로 충분하다고 판시한 것으로는 볼 수 없다.
일단 선택발명의 명세서에 효과에 대한 정량적 수치와 실험조건이 기재되어 있다면, 선행발명과의 대비를 통하여 효과의 현저성 여부를 알 수 있으므로 명세서 기재요건을 갖춘 것으로 보아야 하고, 정량적으로 기재된 수치를 선행발명과 대비하여 보니 현저한 것으로 인정되지 않는다 하더라도(예를 들어, 효과의 현저함을 인정할 수 있는 정량적 차이가 ‘10’ 정도인데, ‘5’ 정도의 차이만 기재되어 있는 경우), 이는 진보성 판단에 있어서 효과의 현저성을 인정할 수 있는지의 문제이지 명세서 기재요건의 문제는 아니라고 보아야 한다.
한편, 선행발명에는 그 효과에 대한 정량적 기재가 없어 선택발명의 효과를 정량적으로 기재한다 하더라도 양 발명의 명세서 대비만으로는 양적 현저함을 알 수 없는 경우도 있을 수 있으나, 진보성 판단에 있어서 기준이 되는 통상의 기술자는 출원시에 있어 당해 기술분야의 기술상식을 보유하고 있고 선행발명을 포함하여 출원시의 기술수준에 있는 모든 자료를 입수하여 자신의 지식으로 할 수 있으며 발명의 과제와 관련되는 기술분야의 지식을 자신의 지식으로 할 수 있다는 것을 전제로 하므로, 선행발명의 명세서 자체에 정량적 기재가 없다 하더라도 선행발명이 가지는 효과로부터 정량적 수치를 짐작할 수 있다고 보아야 할 것이어서 선택발명의 정량적 기재만 있으면 양 발명의 효과 대비가 가능하다.
그러나 효과의 내용만을 알 수 있는 정성적 기재만 있거나 이와 함께 양적 차이에 관하여는 ‘우수하다’, ‘현저하게 우수하다’라는 방식의 추상적인 표현만 있는 경우에는, 명세서 기재만으로 선택발명과 선행발명의 효과 차이가 어느 정도인지 알기 어려우므로 효과의 기재가 명확하다고 보기 어렵다. 그러나 정성적 기재와 함께, 실험대상물이 다수인 경우 실험대상물을 구체적으로 특정하고 실험방법과 조건을 구체적으로 제시하며 이러한 효과로 인하여 선행발명으로는 해결하지 못한 과제를 해결할 수 있음이 기재되어 있는 등으로, 정량적 기재가 없더라도 통상의 기술자가 이러한 기재를 통하여 선행발명의 효과보다 양적으로 현저하게 우수하다는 점을 예측할 수 있다면 효과의 기재가 명확하다고 볼 수 있다.
(4) 기재불비와 진보성 판단에서의 효과 기재 정도
구 특허법 제8조 제3항 의 요건은 발명의 상세한 설명의 기재요건이므로, 선택발명의 효과 기재가 같은 항 소정의 요건을 갖추지 못하여 기재불비에 해당하는 경우에는, 선택발명의 실제 효과가 선행발명에 비하여 특별하고 현저한지 여부를 따질 필요 없이 특허를 부여받을 수 없다(명세서 기재요건의 문제).
한편, 발명의 진보성 판단단계에서 발명이 선행발명에 비하여 현저한 효과가 있는지 여부를 판단함에 있어서, 발명의 명세서에 기재되어 있지 아니하거나 통상의 기술자가 명세서 기재로부터 예측할 수 있는 효과가 아닌 것은 고려할 수 없으므로( 대법원 1997. 5. 30. 선고 96후221 판결 참조), 선택발명에 있어서도 ‘특별하고도 현저한 효과’가 명세서에 기재되어 있지 않다면 진보성 판단에 있어서 사후 실험을 통해 입증된 효과를 선택발명의 효과로 인정할 수 없다(발명의 효과 인정의 문제).
원래 명세서 기재요건의 문제와 발명의 효과 인정의 문제는 서로 구별되는 것이나, 선택발명의 ‘특별하고도 현저한 효과’는 선택발명에 특허가 부여되는 근거로서 일반발명에 있어서의 ‘구성’과 같은 성격을 가지므로, 의약의 용도발명에 있어서 약리효과의 기재가 있어야 발명의 완성과 동시에 명세서의 기재요건을 충족하는 것처럼( 대법원 2004. 12. 23. 선고 2003후1550 판결 참조), 선택발명의 효과 기재는 명세서 기재요건의 문제와 발명의 효과 인정의 문제에 모두 해당된다(선택발명의 효과 기재를 대법원 2001후2740 판결 은 발명의 효과 인정의 문제로 다루었고, 대법원 2005후3338 판결 은 명세서 기재요건의 문제로 다루었다).
한편, 위 양 문제에 있어서 판단 기준은 모두 통상의 기술자가 선택발명의 ‘특별하고도 현저한 효과’를 인식할 수 있는지 여부이므로, 요구되는 기재의 수준은 동일하다고 보아야 한다.
(5) 선택발명의 효과가 수개인 경우
(가) 문제점
선택발명이 선행발명에 비하여 가지는 ‘특별하고도 현저한 효과’가 둘 이상 있을 때, 각 효과에 대하여 명세서 기재요건을 모두 갖추어야 하는가라는 문제가 있다. 이를 긍정하는 입장(이하 ‘긍정설’이라 한다)에 의하면, 모든 효과에 대하여 명확한 기재가 있어야 하고, 어느 하나의 효과에 있어서라도 명세서 기재요건을 갖추지 못하게 되면 발명 전체가 특허를 부여받지 못하게 되지만, 이를 부정하는 입장(이하 ‘부정설’이라 한다)에 의하면, 어느 하나의 효과라도 명세서 기재요건을 갖추면 일단 기재불비의 문제는 해소되며, 실제 ‘특별하고도 현저한 효과’가 인정되는지 여부는 진보성 판단의 문제로 취급된다. 긍정설의 입장은, 선택발명은 명세서 기재요건도 갖추고 실제 효과의 현저함도 인정되어야 특허를 부여받을 수 있는 것인데, 부정설을 취할 경우 어느 하나의 효과는 명세서 기재요건을 갖추지 못하고, 다른 효과는 명세서 기재요건만 갖추었지 실제 현저한 효과가 없는 경우(아래의 ①사례)에도 특허를 부여하여야 하므로 불합리하다는 것을 논거로 한다.
(나) 사례의 상정
① 사례 :  와
와  의 두 효과 중
의 두 효과 중  효과에 대하여 명세서 기재요건은 충족하지만 실제 기재된 효과가 인정되지 않는 반면,
효과에 대하여 명세서 기재요건은 충족하지만 실제 기재된 효과가 인정되지 않는 반면,  효과에 대하여 명세서 기재요건은 충족하지 못하지만 실제 ‘특별하고도 현저한 효과’가 인정되는 경우
효과에 대하여 명세서 기재요건은 충족하지 못하지만 실제 ‘특별하고도 현저한 효과’가 인정되는 경우
② 사례 :  와
와  의 두 효과 중
의 두 효과 중  효과에 대하여 명세서 기재요건도 충족하고 ‘특별하고도 현저한 효과’도 인정되는 반면,
효과에 대하여 명세서 기재요건도 충족하고 ‘특별하고도 현저한 효과’도 인정되는 반면,  효과에 대하여 명세서 기재요건은 충족하지 못하지만 ‘특별하고도 현저한 효과’는 인정되는 경우
효과에 대하여 명세서 기재요건은 충족하지 못하지만 ‘특별하고도 현저한 효과’는 인정되는 경우
(다) 사례의 적용과 이 법원의 입장
① 긍정설의 입장에 의하면, 위 ①사례와 ②사례 모두 명세서 기재요건을 충족하지 못하여 특허를 부여받지 못하게 된다.
그러나 부정설의 입장에 의하면, 위 ①사례와 ②사례 모두 명세서 기재요건을 충족하게 되나, ①사례의 경우  효과는 실제 증거에 의하여 현저한 효과가 인정되지 않고,
효과는 실제 증거에 의하여 현저한 효과가 인정되지 않고,  효과는 실제 증거에 의하여 현저한 효과가 인정된다 하더라도, 위 (4)항에서 살펴본 바와 같이 명세서에 기재되거나 이로부터 예측할 수 있는 범위를 넘는 효과이어서, 진보성 판단에 있어 발명의 효과로 인정될 수 없으므로 결국, 특허를 부여받지 못하게 되므로, 긍정설이 상정하는 불합리가 발생하지 않는다(②사례의 경우에는 당연히 특허 부여됨).
효과는 실제 증거에 의하여 현저한 효과가 인정된다 하더라도, 위 (4)항에서 살펴본 바와 같이 명세서에 기재되거나 이로부터 예측할 수 있는 범위를 넘는 효과이어서, 진보성 판단에 있어 발명의 효과로 인정될 수 없으므로 결국, 특허를 부여받지 못하게 되므로, 긍정설이 상정하는 불합리가 발생하지 않는다(②사례의 경우에는 당연히 특허 부여됨).
② 한편, ㉮ 선택발명이 목적으로 하는 효과가 수개인 경우, 선택발명의 진보성은 선행발명의 효과와 대비하여 모든 종류의 효과 면에서 현저한 차이가 있어야 하는 것이 아니라, 선택발명의 효과 중 일부라도 이에 대응하는 선행발명의 효과에 비하여 현저하다고 인정되면 충분한 것이라는 점( 대법원 2003. 10. 24. 선고 2002후1935 판결 참조), ㉯ 통상의 기술자로서는 선택발명이 목적으로 하는 수개의 효과 중 어느 하나라도 ‘특별하고도 현저한 효과’를 가지면 선행발명 대신에 선택발명을 선택하여 실시할 것이고, 또 다른 효과의 기재가 불명확하다고 하여 선택발명의 실시를 포기하지 않을 것이어서 선택발명의 실시가능성을 충족하는 점, ㉰ 위 ②사례의 경우,  효과만으로도 특허를 부여할 가치가 충분하고, 추가로
효과만으로도 특허를 부여할 가치가 충분하고, 추가로  효과까지 주장한다고 하여 발명의 가치가 떨어지는 것이 아님에도 긍정설을 취할 경우 특허를 부여하지 못하는 불합리가 생긴다는 점, ㉱ 일반발명에 있어서 구성의 기재가 불명확한 경우에는 발명을 파악하거나 이를 실시하기 불가능하기 때문에 명세서 기재요건의 불비로 특허를 부여하지 않아야 하나, 단지 효과의 기재가 불명확하다고 하여 특허성을 부정하지는 않는 점, ㉲ 선택발명의 경우 ‘특별하고도 현저한 효과’가 일반발명에 있어서 ‘구성’에 해당하는 것으로서 그 기재의 명확성이 요구되는 것은 앞서 살펴본 바와 같이 발명의 실시가능성과 관련되기 때문이나, 어느 하나의 효과라도 명세서 기재요건 및 효과의 현저성이 충족되는 경우 실시가능성도 충족되며, 이로 인하여 발명이 불명확하게 되는 것은 아니라는 점 등의 모든 사정을 참작하여 보면, 위 두 가지 입장 중 부정설을 취하는 것이 옳다.
효과까지 주장한다고 하여 발명의 가치가 떨어지는 것이 아님에도 긍정설을 취할 경우 특허를 부여하지 못하는 불합리가 생긴다는 점, ㉱ 일반발명에 있어서 구성의 기재가 불명확한 경우에는 발명을 파악하거나 이를 실시하기 불가능하기 때문에 명세서 기재요건의 불비로 특허를 부여하지 않아야 하나, 단지 효과의 기재가 불명확하다고 하여 특허성을 부정하지는 않는 점, ㉲ 선택발명의 경우 ‘특별하고도 현저한 효과’가 일반발명에 있어서 ‘구성’에 해당하는 것으로서 그 기재의 명확성이 요구되는 것은 앞서 살펴본 바와 같이 발명의 실시가능성과 관련되기 때문이나, 어느 하나의 효과라도 명세서 기재요건 및 효과의 현저성이 충족되는 경우 실시가능성도 충족되며, 이로 인하여 발명이 불명확하게 되는 것은 아니라는 점 등의 모든 사정을 참작하여 보면, 위 두 가지 입장 중 부정설을 취하는 것이 옳다.
라. 이 사건에서의 적용
(1) 약리효과 및 독성효과 기재의 적법성
이 사건 특허발명의 약리효과는 ‘혈소판 응집저해 작용 및 항혈전 작용’을 의미하는데, 이 사건 특허발명의 명세서에는 약리효과와 독성효과와 관련하여, “뜻밖으로 우선성 광학이성질체 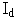 만이 혈소판 응집 저해작용을 나타내고 좌선성 광학이성질체
만이 혈소판 응집 저해작용을 나타내고 좌선성 광학이성질체 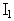 은 그러한 작용을 나타내지 않는다. 더욱이 비활성 좌선성 광학이성질체
은 그러한 작용을 나타내지 않는다. 더욱이 비활성 좌선성 광학이성질체 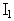 은 상기 두 가지 광학이성질체 중 내성이 적은 것이다.”(갑가 제2호증, 제219면, 아래에서 제1 내지 3행), “이 새로운 화합물의 혈소판 응집 저해작용 및 독성을 프랑스 특허 출원 제82.12599호(공고 제2 530 247호)(비교대상발명 1의 프랑스 대응 특허)에 기술된 라세미 혼합물과 비교하였다. 본 발명의 또 다른 장점을 나타내는 이 연구의 결과가 이하에서 기술될 것이다. 즉, 우선성 광학이성질체의 염이 라세미 혼합물의 염보다 치료계수가 높다. 사실상 좌선성 광학이성질체는 혈소판 응집 저해작용을 나타내지 않으며, 그의 독성은 우선성 광학이성질체보다 훨씬 높다.”(갑가 제2호증, 제226면, 제6 내지 9행), “라세미 혼합물의 독성이 좌선성 광학이성질체와 비슷하고 우선성 광학이성질체의 독성은 매우 적으며…”(갑가 제2호증, 제228면 표 IV 위의 제2 내지 3행), “이상과 같은 약물학적 연구는 우선성 광학이성질체(
은 상기 두 가지 광학이성질체 중 내성이 적은 것이다.”(갑가 제2호증, 제219면, 아래에서 제1 내지 3행), “이 새로운 화합물의 혈소판 응집 저해작용 및 독성을 프랑스 특허 출원 제82.12599호(공고 제2 530 247호)(비교대상발명 1의 프랑스 대응 특허)에 기술된 라세미 혼합물과 비교하였다. 본 발명의 또 다른 장점을 나타내는 이 연구의 결과가 이하에서 기술될 것이다. 즉, 우선성 광학이성질체의 염이 라세미 혼합물의 염보다 치료계수가 높다. 사실상 좌선성 광학이성질체는 혈소판 응집 저해작용을 나타내지 않으며, 그의 독성은 우선성 광학이성질체보다 훨씬 높다.”(갑가 제2호증, 제226면, 제6 내지 9행), “라세미 혼합물의 독성이 좌선성 광학이성질체와 비슷하고 우선성 광학이성질체의 독성은 매우 적으며…”(갑가 제2호증, 제228면 표 IV 위의 제2 내지 3행), “이상과 같은 약물학적 연구는 우선성 광학이성질체( 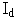 )가 혈소판 응집 저해작용을 가지며 좌선성 광학이성질체(
)가 혈소판 응집 저해작용을 가지며 좌선성 광학이성질체( 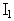 )은 아무런 작용을 갖지 않음을 나타낸다.”(갑가 제2호증, 제229면, 표 아래 제2 내지 3행)라고 각 기재되어 있고, 표 I 내지 IV에는 이 사건 특허발명의 클로피도그렐 염산염, 황산수소염, 브롬산염과 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염에 대한 혈소판 응집저해 작용 및 항혈전 작용과 독성에 관한 실험결과를 정량적인 데이터로 대비하여 기재되어 있다.
)은 아무런 작용을 갖지 않음을 나타낸다.”(갑가 제2호증, 제229면, 표 아래 제2 내지 3행)라고 각 기재되어 있고, 표 I 내지 IV에는 이 사건 특허발명의 클로피도그렐 염산염, 황산수소염, 브롬산염과 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염에 대한 혈소판 응집저해 작용 및 항혈전 작용과 독성에 관한 실험결과를 정량적인 데이터로 대비하여 기재되어 있다.
따라서 이 사건 특허발명 중 제1항 내지 제5항 각 발명은 그 명세서에 약리효과와 독성효과에 대하여 효과의 내용과 유용성, 비교대상발명 1과 대비한 정량적 데이터가 기재되어 있어, 명세서의 기재만으로 선행발명과의 효과 차이를 인식할 수 있으므로 명세서 기재요건을 충족한다.
(2) 제제학적 효과 기재의 적법성
(가) 비교대상발명 1의 효과와의 이동(이동)
이 사건 특허발명의 제제학적 효과는 결정성, 수용성, 비흡습성을 포함하는 것인데, 비교대상발명 1에 이러한 제제학적 효과에 대한 명시적인 기재는 없다. 그러나 발명의 진보성을 판단함에 있어, 특허발명의 유리한 효과가 발명의 상세한 설명에 기재되어 있지 아니하더라도 통상의 기술자가 상세한 설명의 기재로부터 유리한 효과를 추론할 수 있을 때에는 진보성 판단을 함에 있어서 그 효과도 참작하여야 하는 것( 대법원 2002. 8. 23. 선고 2000후3234 판결 참조)과 마찬가지로, 특허발명과 대비되는 선행발명의 효과 역시 명시적으로 기재된 효과뿐만 아니라 통상의 기술자가 선행발명으로부터 예측할 수 있는 효과까지 함께 고려하여 판단하여야 한다( 대법원 2003. 12. 26. 선고 2001후2702 판결 , 대법원 2006. 3. 24. 선고 2004후2307 판결 , 대법원 2007. 1. 26. 선고 2005후582 판결 등 참조).
비교대상발명 1의 명세서에는, “메틸-α-[4,5,6,7-테트라하이드로-티에노(3,2,-C)-5-피리딘]-o-클로로페닐-아세테이트 …중략… 황색오일이 얻어졌으며, 이것을 그의 하이드로클로라이드로 정제시킨 결과 백색 결정이 얻어졌다.”(갑가 제5호증 제5면 실시예 1)라는 기재가 있으므로, 우선 위 기재로부터 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염은 결정성을 가진다는 사실을 알 수 있다. 그리고 이 사건 특허발명의 기술분야에서 오일상의 물질을 염화함으로써 통상 개선을 기대할 수 있는 물리화학적 성질은 안정성(stability), 용해성, 흡습성, 유동성, 약동학적 특성, 흡수성 등이므로(갑가 제32호증의 2 제1418면 오른쪽 열 제19 내지 22행, 제33호증 제322면 제1열 제1 내지 6행), 통상의 기술자로서는 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염은 어느 정도의 수용성과 비흡습성도 가진다는 것을 충분히 예측할 수 있을 것이다.
따라서 이 사건 특허발명이 가지는 제제학적 효과는 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염의 효과와 대비하여 이질적 효과가 아니라 동질의 효과이다.
(나) 명세서 기재 내용
이 사건 특허발명의 명세서에는 위와 같은 제제학적 효과와 관련하여 다음과 같은 기재만 있다.
“화합물( 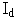 )은 오일인 반면, 그의 염산염은 흰색 분말이다. 오일성 물질은 보통 정제하기 어려우므로 약제학적 조성물의 제조를 위해서는 재결정화에 의해 정제될 수 있는 결정성 물질을 사용하는 것이 바람직하다. 그러나 화합물(
)은 오일인 반면, 그의 염산염은 흰색 분말이다. 오일성 물질은 보통 정제하기 어려우므로 약제학적 조성물의 제조를 위해서는 재결정화에 의해 정제될 수 있는 결정성 물질을 사용하는 것이 바람직하다. 그러나 화합물( 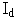 )의 염 중 몇 가지는 무정형으로 침전되거나 공업적 규모로 다루기 힘든 성질인 흡습성을 나타낸다는 것이 본원에서 관찰되었다. 그러므로 약학에서 보통 사용되는 카르복실산 및 설폰산, 예를 들면 아세트산, 벤조산, 말레산, 푸마르산, 타르타르산, 젠티스산, 메탄 설폰산, 에탄 설폰산, 벤젠 설폰산, 라우릴 설폰산뿐 아니라 정제하기 어려운 도베실산 및 파라 톨루엔 설폰산의 염이 제조되었다. 구조식(
)의 염 중 몇 가지는 무정형으로 침전되거나 공업적 규모로 다루기 힘든 성질인 흡습성을 나타낸다는 것이 본원에서 관찰되었다. 그러므로 약학에서 보통 사용되는 카르복실산 및 설폰산, 예를 들면 아세트산, 벤조산, 말레산, 푸마르산, 타르타르산, 젠티스산, 메탄 설폰산, 에탄 설폰산, 벤젠 설폰산, 라우릴 설폰산뿐 아니라 정제하기 어려운 도베실산 및 파라 톨루엔 설폰산의 염이 제조되었다. 구조식( 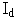 )의 화합물의 우선성 광학이성질체의 무기산염 또는 유기산염 중 쉽게 결정화되고 흡습성을 갖지 않으며 특히 유리한 활성 의약품으로 사용될 수 있는 수용성 염이 발견되었다. 그 결과 본 발명은 보다 구체적으로, 메틸 α-5(4,5,6,7 테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐) 아세테이트의 우선성 광학이성질체의 황산수소염, 타우로콜린산염 및 브롬산염에 관한 것이다.”(갑가 제2호증, 제220면, 제4 내지 12행)
)의 화합물의 우선성 광학이성질체의 무기산염 또는 유기산염 중 쉽게 결정화되고 흡습성을 갖지 않으며 특히 유리한 활성 의약품으로 사용될 수 있는 수용성 염이 발견되었다. 그 결과 본 발명은 보다 구체적으로, 메틸 α-5(4,5,6,7 테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐) 아세테이트의 우선성 광학이성질체의 황산수소염, 타우로콜린산염 및 브롬산염에 관한 것이다.”(갑가 제2호증, 제220면, 제4 내지 12행)
(다) 명세서 기재요건의 충족 여부
이 사건 특허발명의 명세서에는 제제학적 효과(이 사건 제2항 내지 제5항의 특정염에 관한 발명이 가지는 효과)와 관련하여, “쉽게 결정화되고 흡습성을 갖지 않으며 특히 유리한 활성 의약품으로 사용될 수 있는 수용성”이라고 효과의 내용이 정성적으로 기재되어 있을 뿐, 효과의 정도에 관한 정량적인 기재가 전혀 없고, 제제학적 효과를 확인하는 실험방법과 조건이 구체적으로 제시되어 있지 않다. 그리고 위와 같은 제제학적 효과를 통하여 해결할 수 있는 기술적 과제로, 약제학적 조성물의 제조에 있어 ‘무정형으로 침전되거나 공업적 규모로 다루기 힘든 흡습성’의 문제를 기재하고 있으나, 이는 이 사건 특허발명의 기술분야에서 오일상 물질을 염화함으로써 통상 해결할 수 있는 기술적 과제에 불과하며, 비교대상발명 1이 해결하지 못한 기술적 과제를 해결하였다는 기재도 없다.
따라서 통상의 기술자로서는 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염으로부터 예측할 수 있는 결정성, 수용성, 비흡습성에 비하여, 이 사건 특허발명의 클로피도그렐 염산염, 황산수소염, 브롬산염, 타우로콜린산염이 가지는 결정성, 수용성, 비흡습성이 어느 정도 우수한지 즉, 제제학적인 면에 있어서 선택발명으로서의 ‘특별하고도 현저한 효과’를 가지는지 여부를 알 수 없다. 그리고 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염과 이 사건 특허발명의 위 각 염이 가지는 약리효과가 비슷할 경우, 이 사건 특허발명의 명세서 기재 내용을 보고, 제제학적 효과의 우수성 때문에 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염 대신에 이 사건 제2항 내지 제5항 발명을 선택하여 실시할 것이라고 기대할 수도 없다.
결국, 이 사건 특허발명의 명세서 기재는 명확하지 아니하여 통상의 기술자가 용이하게 실시할 수 없는 것에 해당하므로, 명세서 기재요건을 충족한 것이라고 볼 수 없다.
(3) 이 사건의 특수성(양 효과의 관계)
이 사건 특허발명의 효과는 세부적으로 혈소판 응집저해 작용 및 항혈전 작용, 저독성, 결정성, 수용성, 비흡습성으로 나누어 볼 수 있고, 어떤 물질을 의약용도로 선택함에 있어서 혈소판 응집저해 작용 및 항혈전 작용 등 약리효과와 독성효과를 함께 고려하고(위 두 효과의 상관관계를 나타내는 지수가 치료계수인데, 약리효과가 뛰어나더라도 독성이 강하다면, 그보다 약리효과가 조금 못하면서 저독성인 물질을 선택할 것이고, 독성이 강하더라도 약리효과를 대체할 물질이 전혀 없다면 그 물질을 선택하는 등으로 양 효과는 서로 보완적인 관계에 있다), 결정성, 수용성, 비흡습성 등 제제학적 효과 역시 제약에 있어 함께 고려한다는 점에서, 크게 2가지로 분류할 수 있다.
그런데 이 사건 특허발명의 효과 중 약리효과와 독성효과에 대하여 명세서 기재요건을 충족하였음은 앞서 살펴본 바와 같으므로, 비록 제제학적 효과에 대하여 명세서 기재요건을 충족하지 못하였다 하더라도 위 다.(5)항에서 살펴본 바와 같이 이 사건 특허발명의 명세서 전체는 그 기재요건을 충족한 것으로 보아야 한다.
마. 소결론
따라서 이 사건 제1항 내지 제5항 각 발명은 구 특허법 제8조 제3항 소정의 명세서 기재요건을 충족하였으므로, 기재불비의 위법이 없다.
6. 이 사건 제1항 발명에 관한 판단
가. 당사자의 주장
(1) 원고 주장의 요지
(가) 신규성에 관하여
어떤 화합물의 라세미체가 공지되어 있고 부제탄소가 하나 존재하는 화합물의 경우에는 이론적으로 두 개의 광학이성질체가 존재할 수 있다는 것이 과학상식이라 하더라도, 특정 광학이성질체가 라세미체에 비하여 약리활성, 독성, 약동학적 성질 등의 면에서 이질의 효과, 또는 동질이지만 현저히 우수한 효과를 갖는지 여부는 광학이성질체를 실제로 분리하여 실험을 통해 그 성질을 확인해 보지 않고서는 전혀 예측할 수 없으므로, 화합물의 특정 광학이성질체에 대한 발명은 상위개념인 라세미체에서 특정 광학이성질체를 선택하는 선택발명으로 취급되어야 한다.
그런데 비교대상발명 1의 명세서에 ‘각각의 에난티오머’라는 기재가 있으나, 이는 포괄적 범위의 일반식(Ⅰ)에 해당하는 화합물이 두 개의 광학이성질체 형태로 존재할 수 있다는 일반적 가능성을 기재한 것일 뿐이고, 명세서에 그 광학이성질체를 분리하여 확인한 사실이나 그 분리 방법이 기재되어 있거나, 두 개의 광학이성질체 중 하나를 선택할 만한 명확한 동기가 제공되어 있는 것도 아니므로, 이 사건 제1항 발명의 클로피도그렐을 구체적으로 개시한 것이라고 볼 수 없다.
(나) 진보성에 관하여
이 사건 제1항 발명의 클로피도그렐은 비교대상발명 1에 개시된 화학식(Ⅰ)의 라세미체에 비하여 두 배 이상의 약리활성과 1/2의 수준의 독성을 가지므로, 총체적으로 약 4배의 우수한 효과를 가지고, 경련을 일으키지 않는 부작용 감소의 효과도 가지는데, 약물이 안전하고 유효하게 투여될 수 있는 범위를 나타내는 치료계수를 구하여 보면 라세미체에 비해 약 4배 내지 16배의 높은 치료계수를 갖는 것이어서 현저한 효과가 있다.
(2) 피고들 주장의 요지
(가) 이 사건 특허발명의 명세서에 의하면, 이 사건 제1항 발명은 약제학적으로 허용되는 염 중에서도 무정형이거나 공업적 규모로 다루기 힘든 성질인 흡습성을 나타내는 염, 정제하기 어려운 염은 제외하고, 쉽게 결정화되며 흡습성을 갖지 않고 수용성인 염만을 발명의 대상으로 하고 있음에도, 이 사건 제1항 발명의 청구범위에는 이러한 무정형이거나 흡습성인 염도 배제하지 않고 모두 포함하고 있으므로, 이 사건 제1항 발명은 그 청구범위에 발명이 대상으로 삼지 않은 부분도 포함하는 것이어서 미완성 발명에 해당한다(피고 가그룹).
(나) 부제탄소를 1개 가지는 화합물이 두 개의 광학이성질체의 형태로 존재할 수 있음은 이 사건 특허발명의 출원 전 주지의 사실이고, 비교대상발명 1은 화학식(Ⅰ)의 라세미체뿐만 아니라 그 “각각의 에난티오머”도 발명의 대상으로 삼고 있으므로, 이 사건 제1항 발명의 클로피도그렐은 비교대상발명 1에 구체적으로 개시된 것이어서 신규성이 없다.
(다) 약제학 분야에 있어서 공지된 화학물질에 대한 염의 발명은 그 물질과 동일한 것으로 간주되며, 특히 비교대상발명 1에 화학식(Ⅰ) 라세미체의 염산염이 개시되어 있으므로, 이 사건 제1항 발명의 약제학적으로 허용되는 염은 신규성이 인정되지 않거나 통상의 기술자가 용이하게 발명할 수 있는 것으로서 진보성이 인정되지 않는다.
(라) 일반적으로 광학이성질체는 라세미체의 약리효과를 그대로 가지면서 어느 하나의 광학이성질체가 다른 하나의 광학이성질체에 비하여 동질의 약리효과가 우수하게 나타난다는 것은 자명한 것이고, 그 중 어느 광학이성질체에서 우수한 약리효과가 나타나는가는 통상의 기술자가 반복실험에 의해 쉽게 알 수 있는 것이다. 그리고 화학식(Ⅰ)의 라세미체 가운데 우선성 광학이성질체가 차지하는 비율은 1/2이므로, 우선성 광학이성질체와 라세미체를 같은 양으로 비교하는 경우 우선성 광학이성질체가 라세미체에 비해 약리활성이 2배 또는 저독성이 1/2배로 나타나는 것은 당연하다.
나. 발명의 완성 여부에 관한 판단
피고 가그룹은 위 가.(2)(가)항과 같이 이 사건 제1항 발명이 미완성이라고 주장하므로 살피건대, 이 사건 특허발명의 명세서에 의하면, 이 사건 제1항 발명은 비교대상발명 1에 비하여 약리효과가 우수한 클로피도그렐 및 그의 염을 발명의 대상으로 삼는 것이고, 명세서 중에 기재된 ‘쉽게 결정화되고 흡습성을 갖지 않으며 수용성인 염’을 대상으로 하는 것은 제1항 발명이 아닌 제3항 내지 제5항 각 발명임을 알 수 있으므로, 피고 가그룹의 위 주장은 이유 없다.
다. 신규성에 관한 판단
(1) 이 사건 제1항 발명의 내용
‘클로피도그렐’ 및 ‘약제학적으로 허용되는 그의 염’으로 구성된 것이다. 라세미체는 좌선성 광학이성질체와 우선성 광학이성질체가 서로 화학결합을 하지 않고 50:50으로 혼합되어 있는 물질이므로, 라세미체는 상위개념, 광학이성질체는 하위개념에 해당하여, 공지된 라세미체 중 어느 하나의 광학이성질체에 대한 발명은 선택발명에 해당한다.
(2) 비교대상발명 1의 개시 내용
“메틸-α-(4,5,6,7-테트라하이드로 티에노(3,2-C)-5-피리딜)-o-클로로페닐-아세테이트”(갑가 제6호증, 청구항 2), “이들 화합물은 한 개의 비대칭탄소(asymmetrical carbon)를 가지므로, 두 개의 광학이성질체(enantiomer)로 존재한다. 본 발명은 각각의 에난티오머 둘 다와, 그들의 혼합물에 대한 것이다.”(갑가 제6호증 제2면), “[실시예 1] 메틸-α-[4, 5, 6, 7-테트라하이드로-티에노(3, 2-c)-5-피리딘]-O-클로로페닐 아세테이트(R₁=-CH₃, X=2-Cl)(유도체번호 1). 3.47g(0.144몰)의 메틸-2-클로로-O-클로로 페닐 아세테이트와19.82g(0.144몰)의 탄산칼륨을 200㎖의 디메틸 포름아미드 중의 4, 5, 6, 7-테트라하이드로-티에노(3, 2-c)-피리딘의 용액 20g(144몰)에 가했다. 그 다음 용액을 90℃에서 4시간 동안 가열하였다. 반응 혼합물을 실온까지 냉각시키고, 무기염을 여과한 다음 용매를 증발시켰다. 잔기를 물에 취한 다음 에틸 에테르로 추출하였다. 에테르추출물을 물로 세척하고 황산나트륨 상에서 건조시킨 다음 증발시킨 결과 황색 오일이 얻어졌으며 이것을 그의 하이드로 클로라이드로 정제시킨 결과 백색 결정이 얻어졌다.”(갑가 제6호증 제3면)
(3) 클로피도그렐에 관한 판단
(가) 문언적 개시
비교대상발명 1에 기재된 화합물 중 갑가 제6호증 청구항 2에 기재된 “메틸-α-(4,5,6,7-테트라하이드로 티에노(3,2-C)-5-피리딘)-o-클로로페닐-아세테이트”는, 일반식(I)의 화합물에서 X가 2-Cl이고, Y가 OCH₃(즉 Y가 OR이고, R이 CH₃인 경우)인 화합물에 해당하는데, 이는 이 사건 제1항 발명의 ‘메틸 α-5(4,5,6,7-테트라하이드로(3,2-C)티에노 피리딜)(2-클로로페닐)-아세테이트’와 명칭만 달리할 뿐 같은 물질이다.
그리고 비교대상발명 1에는 화학식(Ⅰ)의 라세미체뿐만 아니라, “각각의 에난티오머”도 발명의 대상으로 함을 기재하고 있으므로, 클로피도그렐 역시 문언적으로 기재되어 있다.
(나) 실질적 개시
이에 대하여 원고는 위 가.(1)(가)항과 같이 주장하므로 살피건대, 이 사건 제1항 발명과 같은 화학물질은 다양한 성질을 가지는 것이어서 화학식으로 표현되는 구성 자체만으로는 어떠한 효과를 가지는지, 어떠한 용도에 쓰일 수 있는지 알기 어렵고, 화학물질발명의 본질은 “신규의 유용한 물질을 창제하는 것”이므로, 화학물질 발명의 명세서에는, ① 유용성(특정한 효과의 기재로 표현될 것이다), ② 제조방법, ③ 확인자료 등이 기재되어 있어야 한다. 그리고 선택발명에서의 신규성 요건 즉, 선행발명이 선택발명을 구성하는 하위개념을 구체적으로 개시하고 있는지를 판단함에 있어서는 선행문헌에 선택발명에 대한 문언적인 기재가 존재하는지의 여부뿐만 아니라, 그 기술분야에서 통상의 기술자가 선행문헌의 기재 내용과 출원시의 기술상식에 기초하여 선행문헌으로부터 직접적으로 선택발명의 존재를 인식할 수 있는 정도의 것인지를 참작하여 판단하여야 하며, 부제탄소가 여러 개(n)인 화학물질의 경우 다수(2ⁿ)의 광학이성질체가 존재하므로, 선행발명에 구체적인 광학이성질체를 특정하지 아니하고 ‘라세미체 및 그 각 광학이성질체’라고만 문언적으로 기재되어 있는 경우에는 선택발명의 결격요건인 ‘구체적 개시’가 있다고 볼 수 없을 것이다.
이 사건으로 돌아와 보건대, 화학식(Ⅰ)의 화합물은 부제탄소를 1개 가지고 있으므로 그 광학이성질체가 2개만 존재한다는 것은 통상의 기술자에게 명백한 것이고, 비교대상발명 1의 명세서에는, 화학식(Ⅰ)의 라세미체뿐만 아니라 그 “각각의 에난티오머”를 발명의 대상으로 삼고 있어 클로피도그렐에 대한 명시적인 기재가 있을 뿐만 아니라, 화학식(Ⅰ) 라세미체에 대한 ① 유용성, ② 제조방법, ③ 확인 자료를 모두 기재하면서, “각각의 에난티오머” 역시 라세미체와 마찬가지의 유용성을 갖는 것으로 기재하고 있다. 따라서 비교대상발명 1을 접하는 통상의 기술자로서는, 비교대상발명 1에 화학식(Ⅰ)의 라세미체로부터 클로피도그렐을 실제로 분리하여 실험한 결과가 기재되어 있지 않다 하더라도, 이 사건 특허발명의 출원 전에 공지된 광학이성질체 분리방법에 따라 화학식(Ⅰ)의 라세미체로부터 클로피도그렐을 분리하면{아래 이 사건 제6 내지 9항 각 발명의 진보성 여부에 관하여 살펴보는 바와 같이, 통상의 기술자는 이 사건 특허발명의 출원 전에 공지된, 비교대상발명 2 및 3, 그리고 을가 제4, 5호증에 개시되어 있는 광학분할 방법을 이용하여 화학식(Ⅰ)의 라세미체로부터 클로피도그렐을 용이하게 분리할 수 있다}, 클로피도그렐 역시 그 라세미체와 마찬가지로 혈소판 응집저해 작용 및 항혈전 작용과 낮은 독성을 가지는 물질이어서 약물로서 유용함을 충분히 알 수 있으므로, 이 사건 제1항 발명의 클로피도그렐은 비교대상발명 1에 실질적으로 개시된 것으로 볼 수 있고{이 사건 특허발명의 클로피도그렐이 가지는 효과 역시 (그 양적인 차이는 별론으로 하고) 혈소판 응집저해 작용 및 항혈전 작용과 저독성 효과이어서, 비교대상발명 1로부터 예측할 수 있는 효과에 지나지 않는다}, 따라서 원고의 위 주장은 이유 없다.
(4) 클로피도그렐의 약제학적으로 허용되는 염에 관한 판단
화학물질의 염은 화학물질 고유의 약리학적 용도를 발휘하는 데 영향을 주지 않지만 약물의 흡수력에는 영향을 미칠 수 있기 때문에, 약물 제조시 약제학적으로 허용 가능한 다양한 염의 형태로 만드는 것은 이 사건 특허발명의 기술분야에서 주지·관용적으로 사용되는 기술이다(갑가 제32호증의 2, 제33호증 및 변론 전체의 취지).
따라서 이 사건 제1항 발명과 같이 공지의 화학물질인 클로피도그렐에 대하여 특정염을 선택하지 아니한 채 ‘약제학적으로 허용되는 모든 염’을 대상으로 하는 단순한 염 형태의 발명은, 화학물질인 클로피도그렐과 약리학적 용도가 동일하고, 통상의 기술자가 주지·관용의 기술을 이용하여 쉽게 제조할 수 있으므로 공지의 클로피도그렐 발명과 실질적으로 동일한 것일 뿐만 아니라, 아래 제7항에서 살펴보는 바와 같이 비교대상발명 1에는 이 사건 제1항 발명의 ‘클로피도그렐의 약제학적으로 허용되는 염’에 해당하는 클로피도그렐 염산염이 개시되어 있다.
라. 소결론
이 사건 제1항 발명은 비교대상발명 1에 구체적으로 개시된 것이어서 신규성이 부정되므로, 비록 원고의 주장과 같이 비교대상발명 1에 비하여 현저한 효과를 가진다 하더라도, 나아가 그 진보성 여부에 관하여 살펴볼 필요 없이 그 등록이 무효로 되어야 한다.
7. 이 사건 제2항 발명에 관한 판단
가. 당사자의 주장
(1) 원고 주장의 요지
(가) 이 사건 제2항 발명은 클로피도그렐의 염산염에 관한 것인데, 이 사건 특허발명의 클로피도그렐이 비교대상발명 1에 비하여 신규성 및 진보성이 인정되므로 이 사건 제2항 발명은 당연히 신규성 및 진보성이 인정된다.
(나) 라세미체 화합물과 순수한 광학이성질체는 고체 상태에서의 물리적 성질이 완전히 다르고, 결정성 염을 형성하는 산 또는 염기의 종류도 당연히 다르며, 어떤 화합물의 라세미체가 결정성 염산염을 형성한다고 하여 그 광학이성질체도 역시 그러하리라고 예측할 수 없다.
(다) 이 사건 특허발명 클로피도그렐의 염들 중 일부는 결정화가 어렵거나, 흡습성이거나, 수용성이 너무 낮은 등의 문제점을 갖고 있는데, 이 사건 제2항 발명의 염산염은 위와 같은 문제를 해결할 수 있다는 점에서 추가적인 효과를 갖는다.
(2) 피고들 주장의 요지
비교대상발명 1에 개시된 화학식(Ⅰ) 라세미체의 염산염은 좌선성 광학이성질체의 염산염과 우선성 광학이성질체의 염산염의 동량 혼합물을 제조한 것이므로, 그 중 하나의 성분인 우선성 이성체의 염산염은 비교대상발명 1에 의하여 개시된 것이어서 신규성이 인정되지 않는다.
나. 신규성에 관한 판단
이 사건 제2항 발명은 ‘클로피도그렐의 염산염’인데, 위 제6항에서 살펴본 바와 같이 비교대상발명 1에 구체적으로 개시된 라세미체 화합물에 대하여는 그 각 광학이성질체까지 개시된 것으로 보아야 하고, 비교대상발명 1의 실시에 1에는 화학식(Ⅰ)의 라세미체의 염산염이 기재되어 있으므로, 그 우선성 광학이성질체인 클로피도그렐 염산염도 구체적으로 개시되어 있다고 보아야 한다. 따라서 이 사건 제2항 발명은 신규성을 인정할 수 없다.
다. 소결론
이 사건 제2항 발명은 비교대상발명 1에 의하여 신규성이 부정되므로, 나아가 그 진보성에 관하여 살펴볼 필요 없이 그 등록이 무효로 되어야 한다.
8. 이 사건 제3항 발명에 관한 판단
가. 발명의 완성 여부 및 신규성에 관한 판단
(1) 발명의 완성 여부에 관한 판단
피고 가그룹은, 이 사건 특허발명의 명세서 기재에 의하면, 이 사건 특허발명이 목적으로 하는 기술적 효과는 쉽게 결정화되고 흡습성을 갖지 않으며 특히 유리한 활성 의약품으로 사용될 수 있는 수용성 염을 제공하는 것인데, 을가 제22호증, 제23호증의 각 기재에 의하면, 클로피도그렐 황산수소염은 결정형뿐만 아니라 무정형(비결정형)으로 존재할 수 있음에도, 이 사건 제3항 발명의 청구범위에는 이러한 비결정형을 배제하지 않고 있으므로, 결국 이 사건 제3항 발명은 목적으로 하는 작용효과를 달성하지 못하는 발명도 포함하는 것이어서 미완성 발명에 해당한다고 주장한다.
살피건대, 특허를 받을 수 있는 발명은 완성된 것이어야 하고 완성된 발명이란 통상의 기술자가 반복 실시하여 목적하는 기술적 효과를 얻을 수 있을 정도까지 구체적·객관적으로 구성되어 있는 발명으로, 그 판단은 특허출원의 명세서에 기재된 발명의 목적, 구성 및 작용효과 등을 전체적으로 고려하여 출원 당시의 기술수준에 입각하여 판단하여야 한다( 대법원 1994. 12. 27. 선고 93후1810 판결 )
이 사건으로 돌아와 보건대, 을가 제22호증, 제23호증은 모두 이 사건 특허발명의 출원 후인 2006년과 2004년에 각 공개된 간행물인바, 이 사건 특허발명의 출원 후 기술이 발전함에 따라 클로피도그렐 황산수소염은 결정형뿐만 아니라 비결정형으로 존재할 수 있다는 사실이 밝혀졌다 하더라도, 이러한 출원 후의 기술수준을 발명의 완성 여부를 판단하는 기준으로 삼을 수 없으므로, 피고 가그룹의 위 주장은 이유 없다.
(2) 신규성에 관한 판단
(가) 피고 가그룹 주장의 요지
비교대상발명 1의 실시예 7 및 9에는 일반식(Ⅰ)의 화합물에 속하는 라세미체 황산수소염이 개시되어 있는데, 이는 이 사건 제3항 발명의 클로피도그렐 황산수소염과 비교하여 모핵은 동일하고, 치환기(R)만이 메틸기 대신 n-프로필 또는 이소프로필로 대체된 것으로서, 클로피도그렐과는 탄소수 2개의 차이만 있을 뿐이어서 화학물질로서의 성질에 큰 차이가 없으며, 비교대상발명 1의 라세미체 황산수소염은 그 좌·우 광학이성질체를 포함하는 것이므로, 이 사건 제3항 발명은 비교대상발명 1에 구체적으로 개시된 것이어서 신규성을 인정할 수 없다.
(나) 문언적 개시의 여부
갑가 제5호증의 기재에 의하면, 비교대상발명 1의 실시예에는 일반식(Ⅰ)에 포함되는 21종의 화합물의 제조예가 구체적으로 기재되어 있고, 그 중 화학식(Ⅰ) 라세미체에 해당하는 R이 CH₃이고, X가 2-Cl인 화합물의 염산염은 기재되어 있으나(실시예 1, 유도체번호 1), 나아가 클로피도그렐 황산수소염 또는 화학식(Ⅰ) 라세미체의 황산수소염은 명시적으로 기재되어 있지 않다.
그리고 비교대상발명 1의 명세서에는 일반식(Ⅰ)의 화합물 중 Y가 OH, OR 등으로, X는 수소, 할로겐 또는 저급알킬기 등으로 정의되어 있고, Y가 OR인 경우에는 약제학적으로 허용되는 무기 또는 유기산과의 부가염을 형성할 수 있다는 취지로 기재되어 있으면서도, 위 치환기들 중에서 바람직한 것이 어느 것이고 특정 치환기에 적합한 무기 또는 유기산은 어떤 것인가에 대한 기재는 전혀 없으므로, 묵시적으로 클로피도그렐 황산수소염 또는 화학식(Ⅰ) 라세미체의 황산수소염이 개시되어 있다고 볼 수도 없다.
(다) 실질적 개시 여부
피고 가그룹은 이 사건 제3항 발명의 클로피도그렐 황산수소염은 비교대상발명 1의 라세미체 황산수소염과 실질적으로 동일한 물질이므로 비교대상발명 1에 실질적인 개시가 있다는 취지의 주장을 하므로 살피건대, 비교대상발명 1에 개시된 화합물 중 화학식(Ⅰ)과 근사하면서 황산수소염인 화합물로는, 치환기 R이 CH₂-CH₂-CH₃(실시예 7, 유도체번호 7) 또는 CH₂-CH₂-CH₂-CH₃(실시예 8, 유도체번호 8) 또는  (실시예 9, 유도체번호 9)이고, X가 2-Cl인 화합물 3개가 있는데, 이들은 이 사건 제3항 발명의 클로피도그렐 황산수소염과 비교하여 모핵은 동일하고, 치환기(R)가 메틸기 대신 n-프로필 또는 n-부틸 또는 이소프로필로 대체된 것으로서 클로피도그렐 황산수소염과는 탄소수 2~3개의 차이가 있다.
(실시예 9, 유도체번호 9)이고, X가 2-Cl인 화합물 3개가 있는데, 이들은 이 사건 제3항 발명의 클로피도그렐 황산수소염과 비교하여 모핵은 동일하고, 치환기(R)가 메틸기 대신 n-프로필 또는 n-부틸 또는 이소프로필로 대체된 것으로서 클로피도그렐 황산수소염과는 탄소수 2~3개의 차이가 있다.
그러나 비교대상발명 1의 혈소판 응집 저해작용 및 항혈전작용에 관한 실험결과에 의하면, 아래 표에서 보는 바와 같이 치환기에 탄소수 2~3개의 차이밖에 없는, 화학식(Ⅰ) 라세미체 염산염(유도체번호 1)과 비교대상발명의 각 황산수소염(유도체번호 7, 8, 9) 사이에는 약리효과에 있어 상당한 차이가 있음을 알 수 있으므로, 비록 치환기의 탄소수 2~3개의 차이밖에 없어 화학구조상 의미가 크지 않다 하더라도 실질적으로 동일한 물질이라고 볼 수 없다.
| [표 1] ADP에 의해 유도되는 혈소판 응집작용 억제 효과 | ||
| 생성물 | 투여용량 mg/kg | 응집되지 않은 혈소판의 비율(%) |
| 유도체번호 1 | 3×25 | 94±3 |
| 유도체번호 9 | 3×60 | 66±2 |
| [표 2] 초기응집율 | ||
| 생성물 | 투여용량 mg/kg | 초기응집율 |
| 유도체번호 1 | 3×25 | 0.14±0.03 |
| 유도체번호 7 | 3×100 | 0.66±0.18 |
| 유도체번호 8 | 3×100 | 0.86±0.18 |
| 유도체번호 9 | 3×60 | 0.13±0.01 |
| [표 4] 항-혈전 작용 | ||
| 생성물 | 투여용량 mg/kg | 혈전중량(mg) |
| 유도체번호 1 | 3×25 | 6.56±0.51 |
| 유도체번호 8 | 3×200 | 29.99±3.05 |
따라서 이 사건 제3항 발명의 클로피도그렐 황산수소염은 비교대상발명 1에 개시된 일반식(Ⅰ) 화합물의 황산수소염들과 실질적으로 동일한 물질이라고 보기 어려우므로, 비교대상발명 1에 의하여 실질적으로도 개시되었다고 볼 수 없다.
(3) 정 리
이 사건 제3항 발명은 미완성 발명에 해당하지 아니하고, 비교대상발명 1에 구체적으로 개시되어 있지 아니하여 그 신규성을 부정할 수 없다.
나. 진보성에 관한 판단
(1) 판단 기준
선택발명이 선행발명에 비하여 효과의 현저함이 있다고 하기 위해서는, 선택발명의 효과 모두를 이에 대응하는 선행발명의 효과와 대비하여 모든 종류의 효과 면에서 현저한 차이가 있어야 하는 것이 아니라, 선택발명의 효과 중 일부라도 이에 대응하는 선행발명의 효과에 비하여 현저하다고 인정되면 충분한 것이고( 대법원 2003. 10. 24. 선고 2002후1935 판결 참조), 선택발명에 포함된 모든 발명이 선행발명에 비하여 우수하여야 하므로 선택발명의 가장 열등한 것과 선행발명의 가장 우수한 것을 대비하여야 한다.
(2) 비교대상물질
(가) 비교대상발명 1에 구체적으로 개시된 물질과 대비
선택발명인 이 사건 제3항 발명이 비교대상발명 1에 비하여 진보성이 긍정되기 위하여는, 비교대상발명 1에 포함된 모든 물질에 비하여 '특별하고도 현저한 효과'가 인정되어야 한다. 그러나 비교대상발명 1이 포함하고 있는 일반식(Ⅰ)에 해당하는 화합물은 수백 가지에 이를 수 있고, 구체적으로 개시되어 있지 않는 화합물의 경우에는 통상의 기술자로서도 실제 어떠한 효과를 가지는지 예측하기 어려우므로, 비교대상발명 1에 구체적으로 개시된 21가지 화합물(유도체번호 1 내지 21)과 대비하여야 할 것이다.
그리고 선택발명이 지니는 효과가 여러 개인 경우, 그 중 어느 하나라도 선행발명의 효과에 비하여 현저하다는 점이 인정되면 선택발명의 진보성을 긍정할 수 있을 것이나, 선택발명을 선행발명에 비하여 ‘특별하고도 현저한 효과’를 가진다고 평가할 수 있기 위해서는 선택발명이 가지는 효과 전체를 종합적으로 고려하여야 하므로, 현저성이 인정되는 효과 이외의 나머지 효과가 선행발명에 비하여 현저히 나쁘다면 선택발명의 효과가 선행발명에 비하여 특별하고도 현저하다고 할 수 없을 것이어서, 나머지 효과는 적어도 선행발명의 효과와 비슷한 정도는 되어야 한다.
그런데 원고가 비교대상발명 1에 비하여 우수하다고 주장하는 이 사건 제3항 발명의 효과는 약리효과, 독성효과 및 제제학적 효과이고, 제제학적 효과는 약리효과를 발휘하는 화합물의 제제화를 위하여 필요한 효과이어서, 약리효과가 전제되지 않을 경우(약리효과가 현저히 떨어지는 경우) 제제학적 효과 자체만으로는 별다른 가치는 없는 것이므로, 비교대상발명 1에 구체적으로 개시된 21개의 화합물 중 약리효과가 열등하다면 제제학적 효과가 아무리 우수하다 하더라도 비교대상발명 1의 화합물 중 가장 우수한 효과를 가지는 물질이라고 보기 어렵다. 따라서 비교대상발명 1의 여러 화합물 중 가장 우수한 것은 약리효과가 뛰어난 유도체번호 1 화학식(Ⅰ)의 라세미체이므로(표 1 내지 4의 실험결과 참조), 이 사건 제3항 발명의 효과의 현저성 여부는 비교대상발명 1에 구체적으로 개시된 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염과 대비하면 충분하다.
(나) 이 사건 특허발명의 나머지 청구항의 물질과 대비
특허발명이 수개의 청구항으로 나누어져 있는 경우, 각 청구항의 발명은 독립적인 발명으로서의 효력을 가지고, 등록무효 사유 역시 독립적으로 판단되므로{ 구 특허법(1990. 1. 13. 법률 4207호로 전문 개정되기 전의 것) 제69조 제2항 참조}, 이 사건 제3항 발명이 비교대상발명 1에 비하여 현저한 효과를 가지는지 여부는 비교대상발명 1에 구체적으로 개시된 물질과 대비하면 족하고, 이 사건 제3항 발명과 함께 출원하여 등록받은 다른 청구항의 물질들과 대비하여 현저한 효과를 가져야 하는 것은 아니다.
(3) 약리효과에 관한 판단
(가) 당사자의 주장
① 원고 주장의 요지
㉮ 화학식(Ⅰ)의 화합물은 좌·우 광학이성질체 중 우선성 광학이성질체(클로피도그렐)만이 약리활성을 나타내고, 좌선성 광학이성질체는 아무런 약리활성을 나타내지 않으므로, 이 사건 제3항 발명의 클로피도그렐은 비교대상발명 1에 개시된 화학식(Ⅰ)의 라세미체에 비하여 두 배 이상의 약리활성을 갖는다.
㉯ 자연계에 어느 하나의 광학이성질체가 모든 약리활성을 갖고, 나머지 광학이성질체는 아무런 활성을 갖지 않는 경우는 매우 드물고, 라세미체와 광학이성질체 사이에 활성의 차이가 있다고 하더라도 어떤 경우에 그러한 활성의 차이가 있을 수 있는지, 차이가 있다면 어느 정도인지를 예측할 수 있는 일반화된 법칙이 존재하는 것이 아니어서 우선성 광학이성질체를 선택한 것에 기술적 곤란성이 있다.
㉰ 이 사건 특허발명의 우선성 광학이성질체는 라세미체로부터 단독으로 분리한다고 하더라도, 부제탄소에 결합된 카르보닐기로 인하여 강산(캄포술폰산, 황산 또는 위장 내의 염산 등)을 첨가하는 경우에는 다시 라세미화될 가능성이 높기 때문에, 라세미체와 다른 효과를 얻을 수 있을 것으로 예측하기 어렵다.
② 피고 가그룹 주장의 요지
라세미체는 좌선성 광학이성질체와 우선성 광학이성질체가 화학적 결합 없이 1/2씩 혼합되어 있는 물질이므로, 같은 양의 라세미체와 광학이성질체의 효과를 비교할 때 2배 정도의 효과 차이를 보이는 것을 두고 현저한 효과라고 볼 수 없다.
(나) 실험결과와 공지의 사실
① 클로피도그렐 황산수소염과 화학식(Ⅰ) 라세미체의 염산염의 대비
이 사건 특허발명의 명세서에는, 응집원으로서 ADP를 사용하여 혈소판을 응집한 후 약물을 투여하여 응집저해율을 측정한 실험결과인 [표 I], 응집원으로서 콜라겐를 사용하여 혈소판을 응집한 후 약물을 투여하여 혈소판 응집저해율을 측정한 실험결과인 [표 II], 초기 혈전의 중량에서 약물을 투입한 후 감소된 혈전 중량률을 측정한 실험결과인 [표 III]이 각 기재되어 있다. 그 중 통계수치로서 의미 없는 결과(“n.s. : 무시할 만함”이라고 표시된 값)를 제외하면 아래 표와 같다.
| [표I] ADP에 의해 유도되는 혈소판 응집작용 억제 효과 | |||
| 생성물 | 용량 mg/kg 경구투여 | %저해 | P |
| 라세미체 염산염(PCR 4099) | 2.5 | 17 | 0.05 |
| 5 | 30 | 0.05 | |
| 12.5 | 69 | 0.001 | |
| 17.9 | 74 | 0.001 | |
| 클로피도그렐 황산수소염(SR 25990C) | 2.5 | 33 | 0.01 |
| 5 | 67 | 0.001 | |
| 10 | 80 | 0.001 | |
| [표II] 콜라겐에 의해 유도되는 혈소판 응집작용 억제 효과 | |||
| 생성물 | 투여된 염기 | %저해 | P |
| 라세미체 염산염 | 3.84 | 25 | 0.05 |
| 7.69 | 44 | 0.01 | |
| 클로피도그렐 황산수소염 | 3.84 | 52 | 0.001 |
| 7.69 | 65 | 0.001 | |
| [표III] 혈전 억제 효과 | |||
| 생성물 | 염기의 양 | 편차 | P |
| 라세미체 염산염 | 3.84 | 44 | 0.001 |
| 7.69 | 64 | 0.001 | |
| 15.38 | 74 | 0.001 | |
| 클로피도그렐 황산수소염 | 3.84 | 56 | 0.001 |
| 7.69 | 67 | 0.001 | |
| 15.38 | 69 | 0.001 | |
② 클로피도그렐 황산수소염과 클로피도그렐 염산염의 대비
| [표I] ADP에 의해 유도되는 혈소판 응집작용 억제 효과 | |||
| 생성물 | 용량 mg/kg 경구투여 | %저해 | P |
| 클로피도그렐 염산염(SR25990A) | 2.5 | 35 | 0.01 |
| 5 | 75 | 0.001 | |
| 12.5 | 82 | 0.001 | |
| 클로피도그렐 황산수소염 | 2.5 | 33 | 0.01 |
| 5 | 67 | 0.001 | |
| 10 | 80 | 0.001 | |
| [표II] 콜라겐에 의해 유도되는 혈소판 응집작용 억제 효과 | |||
| 생성물 | 용량 mg/kg 경구투여 | %저해 | P |
| 클로피도그렐 염산염 | 5 | 69 | 0.01 |
| 12.5 | 78 | 0.001 | |
| 클로피도그렐 황산수소염 | 5 | 52 | 0.001 |
| 10 | 65 | 0.001 | |
③ 공지의 사실
갑가 제27호증(제104면 제13행 내지 제25행), 을가 제6호증의 각 기재에 의하면, 라세미체와 그 각 광학이성질체는 물질 자체의 물리화학적 성질은 동일하나, 좌·우 광학이성질체의 원자단 배치구조가 달라(오른손과 왼손이 다름과 같다) 효소 등 다른 물질과의 결합 여부 또는 결합력에 차이를 가져오고(오른손이 왼손 장갑에 들어가지 않는 것과 같은 이치이다), 이로 인하여 다른 물질과 결합으로 나타나는 약리활성(의약품의 효과도 인체 내의 효소와의 결합에 의하여 나타나는 약리활성의 결과이다)에 있어서 차이가 발생할 수 있으며, 이러한 약리활성은 좌·우 광학이성질체 중 어느 한 쪽에서 모두 나타나거나, 양자에 일정 비율로 배분되어 나타날 수 있음이 이 사건 특허발명의 출원 전에 공지된 사실을 인정할 수 있다{참고 : 피고 가그룹이 제출한 참고자료 21(Journal of Medical Chemistry, 1985, Vol. 28, No3, 347-357p)}.
(다) 판 단
위 약리활성에 관한 실험결과에 의하면, 이 사건 제3항 발명인 클로피도그렐 황산수소염의 약리효과는 비교대상발명 1에 구체적으로 개시된 화학식(Ⅰ) 라세미체 염산염에 비하여는 약 2배 높으나 클로피도그렐 염산염에 비하여는 오히려 낮다.
그런데 위 공지사실에 의하면, 좌·우 광학이성질체 중 어느 하나만이 약리활성을 나타낼 수 있고, 라세미체는 우선성 광학이성질체와 좌선성 광학이성질체가 같은 양으로 혼합되어 있으므로, 어느 하나의 광학이성질체만이 약리활성을 가지는 경우 라세미체와 그 광학이성질체를 동일한 양으로 투여하여 실험하면 광학이성질체의 약리효과가 라세미체에 비하여 2배 정도 우수하게 나타나는 것은 당연한 것이며, 화학식(Ⅰ)의 좌·우 광학이성질체 중 어느 것이 약리활성의 대부분을 나타내는지를 알아내는 것은 확률이 1/2이어서 기술적 어려움이 있다고도 할 수 없다(한편, 선택발명의 진보성이 긍정되기 위해서는 선행발명에 비하여 ‘특별하고도 현저한 효과’가 인정되어야 하고, 선행발명에 구체적으로 개시되지 않은 물질을 선택함에 있어 곤란성이 인정되어도 효과의 현저성이 인정되지 않으면 진보성을 인정할 수 없는 것이다).
따라서 이 사건 제3항 발명의 클로피도그렐 황산수소염은 비교대상발명 1의 클로피도그렐 염산염에 비하여 약리효과가 우수하지 못할 뿐만 아니라(이것만으로도 진보성은 부정된다), 화학식(Ⅰ) 라세미체 염산염에 비하여 2배 정도 우수한 약리효과를 보이는 것만으로는 현저한 효과를 갖는다고 볼 수 없다.
(4) 독성효과 및 치료계수에 관한 판단
(가) 당사자의 주장
① 원고 주장의 요지
㉮ 이 사건 제3항 발명은 비교대상발명 1의 라세미체에 비하여 독성이 현저히 낮은 효과가 있고, 통상 약리활성이 더 높은 화합물이 독성도 더 큰 경향이 있으므로, 어느 하나의 광학이성질체가 다른 광학이성질체에 비하여 약리활성과 독성의 모든 면에서 유용한 성질만을 갖는다는 것은 용이하게 예측할 수 없는 현저한 효과이다.
㉯ 화학식(Ⅰ) 화합물의 라세미체 및 좌선성 광학이성질체는 래트와 마우스를 대상으로 한 급성독성실험 및 개코원숭이(비비)를 대상으로 한 1년 동안의 장기투여실험에서 모두 사망 전에 경련을 일으켰으나, 클로피도그렐은 경련을 일으키지 않았다. 경련은 이로 인하여 사망에 이를 수도 있는 치명적 부작용으로서 특히 클로피도그렐과 같은 혈소판 질환 치료를 위해 장기적으로 복용하는 약물의 경우에는 약물이 체내에 축적됨으로써 발생하는 부작용이 큰 문제인데, 경련 유발 여부는 이러한 부작용을 가늠하는 중요한 항목이다. 따라서 경련을 일으키지 않는다는 효과만으로도 클로피도그렐은 비교대상발명 1에 비하여 안전성의 면에서 현저한 효과를 갖는다.
㉰ 이 사건 특허발명의 명세서에는 독성, 내성 및 치료계수에 관하여 기재되어 있는데 이들은 모두 약물의 안전성 측면에서의 효과를 나타내는 것이고, 경련 역시 안정성에 관한 것이며, 이 사건 특허발명이 독성효과를 입증하기 위하여 기재한 급성독성실험에서 실험동물의 사망 전에 일어날 수 있는 경련도 관찰하므로, 경련에 관한 효과는 독성효과에 포함되는 것이며 이 사건 특허발명의 명세서에 기재되어 있는 효과이다.
㉱ 이 사건 특허발명의 클로피도그렐은 비교대상발명 1의 라세미체에 비하여 약리효과가 2배 높고, 독성이 1/2 수준이므로 치료계수는 4배 높으며, 갑가 제11호증에 의한 장기투여시의 부작용을 고려하여 치료계수를 구하면, 클로피도그렐 황산수소염이 비교대상발명 1의 라세미체 염산염에 비하여 치료계수가 약 16배(6667/75=89 : 833/150=5.6) 더 높다.
② 피고 가그룹 주장의 요지
㉮ 약리효과와 마찬가지로 독성효과에 있어서도, 라세미체의 광학이성질체 중 어느 하나가 라세미체에 비하여 1/2 수준의 독성을 갖는 것은 통상의 기술자가 충분히 예측할 수 있는 정도에 불과하다.
㉯ 비교대상발명 1의 화학식(Ⅰ) 라세미체와 이 사건 특허발명의 클로피도그렐 및 그 특정염들은 모두 독성과 관련하여 안전한 영역 내에 있으므로, 클로피도그렐이 라세미체에 비하여 현저한 효과를 갖는다고 할 수 없다. 그리고 치료계수 5 이상이면 안전한 약물인데, 화학식(Ⅰ) 라세미체 염산염의 치료계수는 110.4로서 충분히 안전한 약물이므로, 그 이상의 치료계수는 의미가 없다.
㉰ 급성독성이란 동물에게 수일 내에 사망을 일으키는 양을 투여하여 나온 수치이므로, 일단 의약으로서 사용할 수 있는 안전성을 확보한 의약에서는 그 수치에 차이가 있다고 하여 이를 동일한 용도에 사용하는 데에 있어서의 현저한 작용효과라고 할 수 없고, 급성독성 실험시 투여량은 실제 약물 복용량과 비교하면 엄청나게 많은 양이므로 그러한 조건에서의 경련 여부가 실제 약으로 사용하는 조건에서도 그대로 적용된다고 볼 수 없다.
㉱ 원고의 급성독성시험은 ‘의약품 등의 독성시험기준’ 제3조에 따른 조건(최소한 2종 이상의 시험동물에 대하여, 각각 적어도 2개의 투여경로로 시험)을 충족하지 못한 것으로서 그 결과를 믿을 수 없다. 또한, 위와 같은 신뢰할 수 없는 자료가 경련을 포함하는 모든 종류의 독성이 낮다고 인정할 수 있는 근거가 될 수 없다.
㉲ 우선성 광학이성질체가 경련을 일으키지 않는다는 효과는 이 사건 특허발명의 명세서에 기재되어 있지 아니하므로 이를 진보성 판단을 위한 효과로 삼을 수 없다.
(나) 독성실험과 치료계수의 의의
① 독성학(Toxicology)은 생체 이물질의 부작용에 관한 연구로서, 모든 약물은 그 작용을 나타내서 얻어지는 정도의 미량에서는 독성이 없으나 일정량 이상을 투여하면 어느 정도 유해한 효과를 일으킨다.
② 제약물질에 있어서 안정성은 약물의 독성용량과 치료적 유효성에 필요한 용량 사이의 관계 즉, 독성용량 대 치료용량의 비율{LD50(실험동물 개체수의 50%를 치사에 이르게 하는 투여량) ÷ ED50(50%의 약리효과를 나타내는 데 필요한 용량)}인 치료계수(therapeutic index)에 의하여 나타내는데, 치료계수가 높을수록 약물의 안전성도 높다.
③ 약물의 독성은 급성독성(acute toxicity), 아급성 독성(subacute toxicity)과 만성독성(chronic toxicity)으로 분류되는데, 독성시험은 단계적으로 할 수도 있고 병행하여 동시에 진행할 수도 있다. 급성독성실험은 한 번에 많은 용량의 약물을 동물에 투여한 후 보통 1주일의 기간을 두고 그들의 생사를 관찰하면서 얻은 정보를 기초로 하여 LD50을 산출한다. 이러한 LD50 값은 화합물의 안전성을 나타내는 가장 기초적인 테스트로서, 동물치사에 필요한 화합물의 용량을 결정하여 화합물의 독성 정도를 평가하는 것인데, 물질의 독성에 대한 일반적 지표로서 널리 사용되는 것이며, 동등한 약리 효과를 갖는 약물 후보 중 어떠한 약물이 가장 안전하여 의약품으로서의 개발 가치가 있는지를 상대적으로 비교하는 데 그 의의가 있다.
[인정 근거 : 갑가 제11호증, 제12호증, 제14호증의 2, 변론 전체의 취지]
(다) 실험결과
① 급성독성실험
이 사건 특허발명의 명세서 표 Ⅳ에 의하면, 클로피도그렐 황산수소염(SR 25990C)의 LD50은 2591인데 비하여, 화학식(Ⅰ) 라세미체의 염산염(PCR 4099)의 LD50은 1615, 클로피도그렐 염산염(SR 25990A)의 LD50은 4316이므로, 이 사건 제3항 발명의 클로피도그렐 황산수소염은 비교대상발명 1의 라세미체의 염산염에 비하여 약 1.6배 정도 독성이 낮으나, 비교대상발명 1의 클로피도그렐 염산염에 비하여는 오히려 1.6배 정도 독성이 높다.
② 경련유발효과
갑가 제10호증의 기재에 의하면, 마우스(mouse, 생쥐, 흰쥐), 래트(rat, 마우스에 비해 큰 종류) 및 개코원숭이(비비)에 대한 급성독성 실험결과, 화학식(Ⅰ)의 라세미체 염산염과 좌선성 광학이성질체 염산염은 사망 전에 경련을 유발하였으나, 클로피도그렐 염산염은 경련을 유발하지 않은 사실을 인정할 수 있다.
그리고 갑가 제11호증의 기재에 의하면, 래트와 마우스에 대한 급성독성 실험결과, 화학식(Ⅰ)의 라세미체 및 좌선성 광학이성질체는 경련을 유발하였으나, 클로피도그렐 또는 그의 염은 경련을 유발하지 않았으며, 개코원숭이에 대한 1년 동안의 만성독성 실험결과, 화학식(Ⅰ)의 라세미체는 경련을 유발하였으나 클로피도그렐은 경련을 유발하지 않은 사실을 인정할 수 있다.
(라) 판 단
① 독성효과와 치료계수
㉮ 우선, 이 사건 제3항 발명의 클로피도그렐 황산수소염은 비교대상발명 1의 클로피도그렐 염산염에 비하여 독성은 높고 위 (3)항에서 살펴본 바와 같이 약리효과는 낮으므로 치료계수 역시 더 낮다.
㉯ 다음으로, 이 사건 제3항 발명의 클로피도그렐 황산수소염과 비교대상발명 1의 라세미체 염산염에 관하여 보건대, ㉮ 위 (나)항에서 살펴본 바와 같이, 급성독성실험은 어떠한 물질의 안정성을 알아보기 위하여 행하는 실험이나, 약물의 절대적 안전성을 평가하기 위한 것이 아니라{이러한 점은 식품의약품안전청으로부터 의약품으로 사용할 물질의 임상실험을 허가받기 위하여 급성독성 실험결과를 제출하지만, 실험결과의 일정한 수치를 기준으로 허가 여부를 결정하는 것은 아니라는 점에서 알 수 있다(을가 제13호증, ‘의약품 등의 안전성·유효성 심사에 관한 규정’, 식품의약품안전청 고시 제2003-17호, 제5조 제1항 제4호), 동물치사에 필요한 화합물의 용량을 통하여 동등한 약리 효과를 갖는 약물 후보 중 어떠한 약물이 상대적으로 안전하여 의약품으로서의 개발 가치가 있는지를 알아보기 위한 실험에 불과하다는 점, ㉯ 모든 약물은 일정량 이상을 투여하는 경우 어느 정도의 독성을 지니는 것이고, 미국 약사법(USC 21 : Food and Drug and Cosmetic Act)의 연방규정 제320조{CFR 320.33(c)}(을가 제37호증 제2면)에는 치료계수가 2 이하인 약물은 항시 모니터링을 요하는 반면, 5 이상인 약물은 안전하게 사용할 수 있는 것으로 보는데, 원고의 계산에 따르더라도 비교대상발명 1의 라세미체 염산염의 치료계수가 100을 넘어 충분히 안전한 약물로 볼 수 있다는 점, ㉰ 이 사건 특허발명의 명세서 표 Ⅳ 기재에 의하면, 화학식(Ⅰ)의 ‘염산염’의 경우, 좌선성과 라세미체의 독성이 비슷하고(1702 : 1615), 우선성은 2.6배 독성이 낮으며, ‘클로피도그렐’의 염이라도 염산염은 황산수소염보다 1.3배 독성이 낮은바, 급성독성의 실험결과는 여러 가지 요인의 의하여 영향을 받는 것으로 보여지는 점에 비추어 보면, 비록 이 사건 제3항 발명의 클로피도그렐 황산수소염이 비교대상발명 1의 라세미체 염산염에 비하여 독성이 낮은 효과가 있으나 양자 모두 비교적 안전한 약물에 속하므로, 급성독성이 1.6배 정도 낮고, 치료계수가 3배 정도 높은 것을 두고 양적인 효과 차이가 현저하다고 볼 수 없다.
② 경련유발효과
특허발명이 선행발명에 비하여 현저한 효과가 있는지 여부를 판단함에 있어서, 명세서에 기재되어 있지 아니하거나 통상의 기술자가 명세서 기재로부터 예측할 수 있는 효과가 아닌 것은 고려할 수 없다( 대법원 1997. 5. 30. 선고 96후221 판결 ).
이 사건으로 돌아와 보건대, 경련[경련]이란 근육이 별다른 이유 없이 갑자기 수축하거나 떨게 되는 현상을 일컫는 것으로서, 간질, 히스테리, 뇌종양, 중독 따위가 원인이며 몸 전체에서 일어나는 것과 부분적으로 일어나는 것, 지속적인 것과 간헐적인 것이 있는데, 때로는 경련 그 자체로 인한 호흡곤란 등으로 사망에 이를 수도 있음에도 경련이 일어날 가능성이나 전조가 미리 탐지되지 않는 경우가 많아 특히 위험하고, 의약품의 부작용으로 중요한 경련은 장기적으로 약물을 복용하는 경우 체내에 축적된 약물로 인하여 유발되는 것이다(변론 전체의 취지).
그런데 ① 이 사건 특허발명의 명세서에는 경련에 관하여 아무런 기재가 없고, ② 원고의 주장과 같이 급성독성 실험시에 관찰되는 항목에 경련이 포함되어 있다 하더라도, 이는 약물 투여 후 사망에 이르는 짧은 기간 내에 일어나는 경련에 불과하여, 약물의 독성과는 별도의 사망 원인이 될 수 있다 하더라도 그 의미가 거의 없으며(어차피 단기간 내에 사망한다), ③ 의약품의 부작용으로서 의미 있는 경련은 약물의 장기투여시 축적되는 약물에 의하여 유발되는 것으로서, 만성독성실험시에 나타나는 경련에 의하여 그 가능성을 어느 정도 추정할 수 있을 뿐인데, 급성독성실험시에 경련을 유발하는 약물이라 하더라도 체내 반감기가 짧을 경우 만성독성실험시에 경련을 유발하지 않을 수 있으므로 급성독성실험시에 관찰되는 경련이 만성독성실험시의 경련을 포함하다고 볼 수 없음에도, 이 사건 특허발명의 명세서에는 만성독성실험 또는 만성독성실험시의 경련에 관하여 아무런 기재가 없다.
따라서 원고가 주장하는 이 사건 제3항 발명의 경련을 유발하지 않는 효과는 이 사건 특허발명의 명세서에 기재되어 있지 않고 통상의 기술자가 예측할 수도 없는 것이거나(만성독성실험시의 경련) 별다른 의의가 없는 것이다(급성독성실험시의 경련).
(마) 정 리
위 실험결과에 의하면, 이 사건 제3항 발명의 클로피도그렐 황산수소염은 비교대상발명 1의 클로피도그렐 염산염에 비하여 독성효과가 우수하지 못할 뿐만 아니라(이것만으로도 진보성은 부정된다), 화학식(Ⅰ) 라세미체 염산염에 비하여 1.6배 정도 우수한 저독성효과 및 3배 정도 우수한 치료계수를 보이는 것만으로는 현저한 효과를 갖는다고 볼 수 없다.
따라서 이 사건 제3항 발명은 여러모로 비교대상발명 1에 비하여 현저한 저독성효과가 있다고 인정할 수 없다.
(5) 제제학적 효과에 관한 판단
(가) 제제학적 효과의 의의
① 제제학의 일반적인 의미
약물은 사용목적에 따라 여러 형태로 가공되어 의약품으로 공급되는데, 의약품의 형태를 제형(제형)이라 하고, 제형으로 가공하는 것을 제제화(제제화)라 하며, 가공한 약물을 제제(제제)라 한다. 대부분의 약물은 오일의 형태이어서 가공되지 않은 상태로는 유효성과 안전성에 결점이 있을 뿐만 아니라 제제화하기 곤란하므로, 그 결점을 개량하여 의약품으로서의 유용성을 증대시키는 것이 제제학적 조작이다.
약물을 가장 간편하고 안전하게 사용하는 방법은 복용(복용)이고, 소화관의 영향으로 효과를 기대할 수 없을 경우에는 주사제를 사용한다. 경구투여용은 간장에서 대사를 받으므로 간장대사가 필요한 약물은 주사제로 만들 수 없고, 간장대사로 효과가 줄어드는 경우에는 주사제나 구강정(구강 내 점막을 통한 약물흡수를 의도하는 제제)으로 만든다.
[인정 근거 : 변론 전체의 취지, 피고 가그룹 제출 참고자료 45 참고]
② 제제학적 효과의 진보성 판단 기준
㉮ 일반 발명에서도 마찬가지이나 특히 이 사건 특허발명과 같은 화학물질의 발명에 있어서는 여러 가지 효과를 포함하고 있고, 알려지지 않은 효과가 기술의 발전에 따라 새롭게 밝혀질 가능성도 크므로, 발명의 진보성 판단에 있어서의 ‘효과의 현저성’은 발명이 목적으로 하는 효과를 기준으로 평가하여야 한다.
동질의 효과에 있어서 양적 현저성은 양 발명의 효과 차이가 크면 클수록 쉽게 인정할 수 있는 것이다. 그러나 구체적인 발명의 효과에 있어서 어느 정도의 양적 차이가 있어야 선택발명의 진보성을 긍정할 수 있을 정도의 ‘현저성’에 해당하는지는 발명의 목적에 비추어 필요한 효과의 종류와 정도를 중심으로 판단하여야 하고, 특히 발명의 목적에 비추어 새로운 기술적 과제를 해결할 수 있는 정도인지는 중요한 기준이 될 수 있다. 이는 1~2%의 차이만으로도 선행발명이 해결하지 못한 기술적 과제를 해결할 수 있는가 하면, 100 ~ 200%의 차이로도 새로운 기술적 과제를 해결하지 못하는 효과도 있기 때문에, 발명의 목적을 떠나서 양 발명의 효과 차이의 객관적인 수치는 의미가 없기 때문이다. 따라서 발명의 목적에 비추어 필요한 효과에 필요하고도 충분한 효과의 양적 범위가 있는 경우, 위 범위를 벗어나는 부분은 아무리 효과가 크다 하더라도 그 발명에 있어서는 가치가 거의 없을 것이어서, 이미 선행발명의 효과가 발명의 목적에 비추어 필요하고도 충분한 효과를 갖춘 경우에는 선택발명의 효과가 아무리 크다 하더라도 진보성 판단에 필요한 효과의 현저성을 인정할 수 없다.
② 이 사건 제3항 발명은 ‘클로피도그렐 황산수소염’이라는 물질에 대한 것이고, 이를 다른 목적으로 사용할 경우 양 발명의 결정성, 수용성, 비흡습성에 대한 평가가 달라질 수도 있으나, 이 사건 특허발명의 명세서를 통하여 파악되는 이 사건 제3항 발명의 목적은 혈전 치료제로 유용한 물질을 제공하는 것이며, 이 사건 제3항 발명의 제제학적 효과는 클로피도그렐 황산수소염을 원료물질로 하여 이를 제제화하는 데 필요한 물성이므로, 클로피도그렐 황산수소염을 제제화하는 데 필요한 물성이 무엇이고 어느 정도의 효과가 필요한 것인지를 중심으로 효과의 현저성 여부를 판단하여야 하고, 특히 제제화에 필요한 물성은 제형에 따라 많이 달라지므로 클로피도그렐 황산수소염이 취할 수 있는 제형을 중심으로 효과의 현저성 여부를 판단하여야 한다.
(나) 양 발명 효과의 이동(이동)
위 제5.의 라.(2)항에서 살펴본 바와 같이, 이 사건 제3항 발명은 결정성, 수용성, 비흡습성 등 제제학적 효과에 관하여 정성적으로 기재하고 있을 뿐이고, 통상의 기술자는 비교대상발명 1의 명세서에 기재된 염 형성 관련 기재를 통하여 비교대상발명 1이 구체적으로 개시하고 있는 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염이 의약품으로 제제할 수 있을 정도의 제제학적 효과를 가지는 것임을 예측할 수 있으므로, 이 사건 제3항 발명이 가지는 제제학적 효과는 비교대상발명 1의 효과와 동질의 효과이다.
(다) 현저한 효과의 명세서 기재 여부
① 특허발명이 선행발명에 비하여 현저한 효과가 있는지 여부를 판단함에 있어서, 명세서에 기재되어 있지 아니하거나 통상의 기술자가 명세서 기재로부터 예측할 수 있는 효과가 아닌 것은 고려할 수 없고( 대법원 1997. 5. 30. 선고 96후221 판결 참조), 위 제5의 다. (4)항에서 살펴본 바와 같이, 선택발명이 선행발명에 비하여 가지는 ‘특별하고도 현저한 효과’는 선택발명에 특허가 부여되는 근거로서 일반 발명에 있어서의 ‘구성’과 같은 성격을 가지는 것이어서, 통상의 기술자가 명세서의 기재를 통해 이를 인식할 수 있을 정도로 기재되어야 하며, 이러한 기재가 없는 경우 명세서 기재요건을 충족하지 못할 뿐만 아니라, 발명의 진보성 인정에 있어 발명의 효과로도 고려할 수 없는 것이다.
그런데 위 제5.의 라.(2)항에서 살펴본 바와 같이, 이 사건 특허발명의 명세서에는 이 사건 제3항 발명의 제제학적 효과에 관하여, 비교대상발명 1이 가지는 동질의 효과에 비하여 ‘양적으로 현저하게 우수하다는 점’을 알 수 있도록 기재되어 있지 아니하므로, 원고가 주장하는 제제학적 효과의 우수성은 발명자가 인식하고 완성한 효과의 범위를 넘는 것이어서, 이 사건 제3항 발명의 효과로 인정할 수 없다.
② 또한, 이 사건 특허발명이 의도하는 제제학적 효과는 이 사건 특허발명의 클로피도그렐이 비교대상발명 1에 비하여 약리효과 및 독성효과가 우수한 것을 전제로 클로피도그렐의 염들 중에서 제제학적 효과가 나은 것을 선택한 것이고, 약리효과 및 독성효과와는 별도로 비교대상발명 1에 비하여 우수한 제제학적 효과를 가지는 발명은 아닌데(원고도 이와 같이 주장한다), 위 (3) 및 (4)항에서 살펴본 바와 같이, 이 사건 제3항 발명의 약리효과 및 독성효과는 비교대상발명 1에 비하여 특별하고도 현저함이 인정되지 않으며, 이 사건 제3항 발명의 명세서에 기재된 제제학적 효과만 놓고 보면 통상의 염이 가지는 정도의 효과에 불과하므로, 비교대상발명 1에 비하여 ‘특별하고도 현저한 제제학적 효과’를 가진다고 볼 수 없다.
(위와 같은 판단에 의하면, 이 사건 제3항 발명의 제제학적 효과의 현저성은 실제 그러한 효과를 지니는지 여부에 관하여 더 나아가 판단할 필요 없이 인정할 수 없을 것이나, 아래에서는 보충적으로 이 사건 제3항 발명의 제제학적 효과가 비교대상발명 1에 비하여 현저한 것인지 살펴본다.)
(라) 결정성에 관한 판단
① 원고 주장의 요지
㉮ 클로피도그렐은 화학구조상 메칠에스터(methyl ester)기를 포함하고 있어, 강산이나 강알칼리와 반응할 경우 이 부분이 쉽게 가수분해될 수 있으므로, 통상의 기술자로서는 클로피도그렐을 염화하기 위하여 산성염류 중에서 강산을 피하고 중등도나 약한 산성의 염류를 적용시킬 것이어서, 클로피도그렐의 염 형성제로 황산을 선택한 것은 용이한 것이 아니다.
㉯ 클로피도그렐은 총 43종의 산성물질을 이용하여 염 제조가 시험되었으나 그 중에서 클로피도그렐 황산수소염을 비롯한 단 7종만이 고체염을 형성한 바와 같이 염 형성 자체가 매우 어려운 약물이다.
㉰ 1974년 기준 통계자료에 의하면, 클로피도그렐 황산수소염은 약물의 산성염 전체의 범주에서는 0.25%에 불과하여 염으로서는 매우 드물고, 황산에 의한 염 중에서도 3.3%에 불과한 염 형태이므로, 클로피도그렐의 염 형성제로 황산을 선택하는 데에는 기술적 곤란성이 있다.
㉱ 클로피도그렐 황산수소염을 만들기 위해서는 반드시 냉각된 아세톤을 사용하여야 하고 그 냉각상태도 염이 얻어지는 최종 순간까지 지속적으로 유지하여야 하며 지속적으로 교반하여야 하므로, 다른 염에 비하여 염 형성 자체에 곤란성이 있다.
㉲ 클로피도그렐 유리염기는 3차 아민기가 카이랄 센터의 수소이온을 끌어당기는 인력을 가지기 때문에 라세미화 경향이 강한데, 황산의 한 쪽 수소이온을 받아들여 황산수소염을 형성함으로써 3차 아민기가 더 이상 카이랄 센터로부터 수소이온을 끌어당기지 않아 안정화되는 특성이 있다.
②) 판 단
㉮ 이 사건 제3항 발명의 클로피도그렐 황산수소염이 갖는 결정성 관련 효과는, 정제하기 어려운 오일상 물질인 클로피도그렐 유리염기를 결정화함으로써 약제학적 조성물을 제조하기 쉽게 하였다는 것이나, 비교대상발명 1에도, 실시예로 제조한 화합물이 오일상일 경우 이를 정제시켜 ‘백색결정’을 형성함으로써 동일한 효과를 얻게 되었으므로, 이 사건 제3항 발명이 비교대상발명 1에 비하여 '특별하고도 현저한 효과'를 가진다고 볼 수 없다.
㉯ 이에 대하여 원고는 클로피도그렐을 염화하기 위한 염형성제로 황산을 선택하는 것과 염 형성 자체에 기술적 곤란성이 있으므로 진보성이 인정되어야 한다는 취지의 주장을 한다.
살피건대, 을가 제10호증, 제11호증, 제18호증의 각 기재(각 가지번호 포함)에 의하면, 황산은 염 형성이 잘 되고 가격이 저렴하며 구하기 쉽고 물과 유기용매에 모두 잘 녹아서 취급이 용이할 뿐 아니라 인체에 존재하는 전해질들 중 하나이어서 독성을 일으킬 염려가 없으므로 염산 다음으로 가장 많이 사용되는 염형성제인 사실, 클로피도그렐과 같은 아민 화합물(-N〈)은 염기성 물질이므로 산을 사용하여 염을 형성하여야 하며, 여러 가지 산 중 대부분의 염기성 물질과 염을 잘 형성하는 산은 pKa가 낮은 염산, 황산, 브롬산인 사실을 인정할 수 있고, 비교대상발명 1에 기재된 실시예의 화합물들은 모두 클로피도그렐과 같은 모핵을 가진 아민 화합물들인데 그 오일상 화합물을 결정으로 만들기 위하여 선택한 염형성제는 염산, 황산, 브롬산이므로, 통상의 기술자로서는 이 사건 특허발명의 클로피도그렐을 염화하기 위하여 일반적으로 가장 많이 사용되며, 비교대상발명 1에 개시된 염 형성제인 염산 및 황산을 가장 먼저 적용해 볼 것이어서, 클로피도그렐의 염 형성제로 황산을 선택한 것에 기술적 곤란성을 인정할 수 없을 뿐만 아니라 위 (3)(다)항에서 살펴본 바와 같이 현저한 효과가 인정되지 않는 한 염형성제의 선택이나 염 형성에 있어서의 기술적 곤란성만으로는 진보성을 긍정할 수 없으므로, 원고의 위 주장은 여러모로 이유 없다.
(마) 수용성(수용성)에 관한 판단
① 당사자의 주장
㉮ 원고 주장의 요지
1) 클로피도그렐 황산수소염은 수용해도가 1,000mg/ml에 달하여 비교대상발명 1의 라세미체 염산염 23.88mg/ml, 클로피도그렐 염산염은 162mg/ml에 비하여 현저히 우수하다.
2) 수용성과 관련하여 클로피도그렐 황산수소염이 다른 염들에 비해 가지는 제제학적 이점은 의약품의 제제화 및 동물실험 등 개발과 관련된 것이므로, 다량의 약물이 물에 용해될 수 있는지가 중요하고, 소용량이 물에 완전히 녹는지 여부와는 관련이 없다.
3) 화학물질의 분자 간의 인력이 강하여 녹는 점이 높으면 동일한 이유로 물에 녹기도 어려운 것인데, 클로피도그렐 황산수소염은 180℃ 이상의 높은 녹는 점(광학이성질체 특정염 중에서 가장 높은 녹는 점)을 가졌음에도 용해도가 타 염류에 비하여 높은 것은 매우 특별한 현상이다.
㉯ 피고 가그룹 주장의 요지
1) 클로피도그렐 황산수소염은 물에 녹으면서 물의 pH를 떨어뜨리고, 용액이 산성화됨에 따라 용해도가 증가하게 되므로, 과량을 투여했을 때에는 수용성이 증가하게 되나, 2mg, 20mg, 200mg 등 소량을 투여할 때에는 완전히 녹지 않고 하얀 침전이 생긴다.
2) 경구 투여하는 의약품은 위(위)에서의 용해도인 pH 1.2의 산성용액에서의 용해도가 중요하고, 중성인 물에서의 용해도는 의미가 없으며, 위액의 조건(위산 pH 1.2, 37℃, 위의 부피 250ml, 클로피도그렐 일일 최대 투여량 300mg, 소화시간을 고려한 2시간 교반시간)에서 실시한 용해도 실험에서 클로피도그렐과 라세미체의 모든 염은 물론 유리염기조차도 모두 투여량의 100% 이상이 녹았으므로, 클로피도그렐 황산수소염의 수용성이 현저하다 볼 수 없다.
② 실험조건
㉮ 수용성의 정도는, 용매의 종류, 용매의 pH, 용매의 온도, 경과시간, 실험관을 흔들거나 교반하는지 여부 및 그 시간, 용질의 결정형 등의 실험조건에 따라 결과에 차이가 많으므로, 동일한 물질이라 하더라도 실험조건에 따라 수용해도에 차이가 날 수 있다.
㉯ 이 사건 특허발명의 기술분야에서 의약품 원료에 관한 시험기준으로 공인된 대한약전(을가 제16호증, 을나 제29호증, 제36호증)에는, 의약품 원료(물질)의 수용성 평가 시험방법으로, ‘의약품을 고체의 경우 가루로 한 다음 용매 중에 넣고, 20±5℃에서 5분마다 30초간씩 세게 흔들어 섞을 때 30분 이내에 녹는 정도’를 기준으로 제시하고 있고, 약사법의 식품의약품안전청고시에 해당하는 ‘의약품등 기준 및 시험방법 심사의뢰서 심사규정’(을가 제14호증)의 제5조에는 원료 의약품의 기준 및 시험방법 작성요령에 용해도 기재시 pH에 따른 영향을 기재하도록 규정하고 있다.
㉰ 미국 FDA의 ‘산업 가이드라인(Guidance for Industry)’에는 약물의 최대 용량과 위장관 산도 범위인 pH1 - 7.5 범위, 체온 조건인 37℃ 및 물 한 컵 용량인 250ml를 반영한 조건에서의 용해도를 약물의 수용성 판단 기준으로 제시하고 있고, 약물의 이온화에 따라 용해도의 pH 조건을 정하고 있으며, 약물의 이온화에 의하여 pH가 변할 수 있으므로 용해도 측정에서 USP에서 규정하는 표준 완충액을 사용하는 것이 적절하다고 기재되어 있다(을가 제31호증 제3면).
③ 실험결과
㉮ 물에서의 수용성
1) 원고가 제출한 서울대학교 약학대학 종합약학연구소(이하 ‘서울대연구소’라 한다) 및 한국화학연구원의 실험결과에 의하면, 대한약전의 수용성 실험방법에 의할 경우, 이 사건 제3항 발명의 클로피도그렐 황산수소염과 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염의 물에서의 용해도는 다음 표와 같다(갑나 제7호증, 을나 제41호증).
| 단위(mg/ml) | 클로피도그렐 라세미체 염산염 | 클로피도그렐 염산염 | 클로피도그렐 황산수소염 |
| 서울대연구소 | 23.88±0.68 | 162.82±14.41 | 960.65±134.98 |
| 한국화학연구원 | 27.8 | 162.8 | 1,116.7 |
2) 한편, 이 사건 제3항 발명의 클로피도그렐 황산수소염은 낮은 pH의 용매에서 용해도가 증가하는 경향이 있어, 중성의 물에 많은 양을 한꺼번에 투입할 경우 물의 pH를 낮추면서 900mg/ml 이상의 용해도를 보이고, 실험종료시 용매의 pH는 0.8이 된다. 그러나 클로피도그렐 황산수소염은 pH를 7로 고정한 용매(pH7의 완충액)에서는 녹지 않는 성질을 가지고 있어, 용매인 물의 pH를 낮추는 데 영향이 적은 소량(200mg/ml 이하)을 투입할 경우 일부가 검을 형성하면서 30분 이내에 완전히 녹지 않을 수도 있다{갑가 제2호증(제226면, ‘약물학적 연구’ 이하에는, 약리활성 시험을 위해 시료의 200mg을 ‘에탄올’에 용해하고, 이를 아라비아검을 함유하는 물에 희석하였는데, ‘현탁액’이 생성된 점), 제8호증의 2(제71면 상단, 클로피도그렐 황산수소염이 pH 6~8에서의 수용해도가 거의 ‘0’에 가까우나 pH 3 이하로 내려가면서 급격하게 수용해도가 증가하는 그래프), 제38호증의 4(제1면, “SR25990C를 물에 넣으면 검이 형성된다. SR25990C를 더 넣으면 넣을수록 이 검이 용해는 빨라진다.”라는 기재), 을가 제27호증(클로피도그렐 황산수소염의 200mg 이하의 소량은 물에 모두 녹지 않고 침전이 생긴다는 영남대연구소 실험결과)}.
이에 비하여 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염은 물에서 23.88 ± 0.68(mg/ml), 클로피도그렐 염산염은 물에서 162.82 ± 14.41(mg/ml)의 용해도를 보이므로, 양 발명은 중성의 물에서 많은 용량을 투입할 경우 수용성에 큰 차이가 있다.
㉯ 인공위액과 장액에서의 수용성
1) 피고 가그룹이 제출한 실험결과
| ? | 인공장액(pH6.8)(mg/ml) | 인공위액(pH1.2)(mg/ml) |
| 라세미체 염산염 | 0.12 | 28.8 |
| 클로피도그렐 염산염 | 0.12 | 535 |
| 클로피도그렐 황산수소염 | 14.31 | 724 |
{을가 제28호증, 이화여자대학교 약학연구소(이하 ‘이대연구소’라 한다)의 시험성적서}
| ? | ? | 인공장액(pH6.8) | 인공위액(pH1.2) | ||
| 라세미체 | 유리염기 | 5.43(ug/ml) | 0.44(%) | 1255(ug/ml) | 103.2(%) |
| 염산염 | 6.39 | 0.53 | 1243 | 102.9 | |
| 클로피도그렐 | 염산염 | 4.5 | 0.37 | 1247 | 102.8 |
| 황산수소염 | 9.49 | 0.79 | 1250 | 103.6 | |
{을가 제27호증, 영남대학교 약학대학 부설 약품개발연구소(이하 ‘영남대연구소’라 한다)의 최종보고서}
2) 이대연구소 실험결과에는 인공장액에서의 클로피도그렐 황산수소염의 용해도가 ‘14.31mg/ml’로 측정되었으나, 앞서 살펴본 바와 같이 클로피도그렐 황산수소염은 용매의 pH가 낮아질수록 용해도가 증가하는 성질을 지니는데, 이대연구소의 위 시험성적서에 pH 4에서의 용해도는 ‘6.13mg/ml’로 측정된 점에 비추어 그대로 믿기 어렵고, 영남대연구소의 실험결과는 실험조건이 ‘37℃로 유지된 일정한 pH의 용매에 클로피도그렐 1일 최대 투여량 300mg을 투입하여 2시간 동안 교반’한 결과이다.
④ 판단 기준
수용성이란 어떤 물질이 물에 녹는 성질, 즉 물에 용해되는 성질을 의미하며, 의약품의 원료물질로서의 수용성은 제제의 공정상 편의라는 측면과 완제품으로 사용될 때 체내의 흡수라는 측면에서 관계된다.
제제의 공정상 관계되는 수용성은 제형에 따라 거의 필요 없는 경우도 있고(성형제제), 체액의 조건에서의 수용성이나 정제수에서의 수용성이 중요할 수도 있으므로(용액제제), 의약품 원료물질의 수용성은 그 물질의 가능한 제형을 참작하여 기술적 의의를 판단하여야 한다.
의약품이 인체 내에서 활성을 나타내기 위해서는 어느 정도 녹은 후(용해) 장내에서 흡수되어야 하는데, 약물이 장내에서 흡수되기 위해서는 약물이 체내로 흡수되는 위장과 소장의 pH 조건에서 용해되어야 하고, 장관에서 혈액으로 흡수되기 위한 막투과성(permeability) 및 붕해(dissolution) 등 여러 가지 요건을 충족하여야 하며, 수용해도가 지나치게 높을 경우 막투과성의 저하로 체내 흡수율이 오히려 떨어지는 문제도 있으므로, 약물이 장내 pH 조건에서 적절한 범위의 수용성을 지녀야 한다.
따라서 약물의 체내 흡수에 필요한 수용성은 약물이 녹으면서 용매의 pH 값을 변화시킬 수 있는 정제수에서의 수용성보다 인체 내 체액 조건(pH 1 -7.5)에서의 수용성이 중요하며, 특히 경구용 제형에서는 약물이 위(위)와 장(장)에서 흡수되므로, 장기 내의 pH에서의 용해도가 의미 있다(변론 전체의 취지, 피고 가그룹 제출의 참고자료 24 ‘제형의 원리와 기술’ 및 참고자료 25 ‘제제공학’ 참고).
⑤ 판 단
㉮ 의약품 제제에 있어서의 의의
의약품을 일정한 형상으로 성형 또는 피포하여 만드는 성형제제에 있어서는, 결정성 원료물질을 물에 용해할 필요가 없으므로 수용성은 의미가 없고, 현탁제, 유제, 시럽과 같은 액상제제도 의약물질이 완전히 용해될 필요가 없거나 의약물질 이외의 다른 첨가물을 용해시키기 위한 보조제를 첨가하여야 하므로 정제수에서의 수용성은 거의 의미가 없다. 그리고 주사제의 경우에도, 간장대사를 필요로 하는 약물은 취할 수 없는 제형일 뿐만 아니라 인체 내에서의 체액 조건을 만족하여야 하므로 정제수에서의 수용성은 의미가 없다.
그런데 이 사건 특허발명의 명세서에는, 클로피도그렐 황산수소염에 수용성이 필요한 이유로 “유리한 활성 의약품으로 사용”되기 위한 것 즉, 체내흡수를 위한 측면만 기재되어 있고, 제제 공정상의 필요성에 대한 기재는 없을 뿐만 아니라, 클로피도그렐 황산수소염을 원료로 하여 제조하는 원고의 의약품인 “플라빅스”는 정제(정제)이며(갑가 제69호증), 다른 제형으로 제조될 수 있는 가능성을 시사하는 자료는 없다.
따라서 이 사건 제3항 발명이 비교대상발명 1에 비하여 물에서의 수용성이 우수하나 이러한 효과는 의약품 제제에 있어서는 큰 기술적 의의가 없어 보인다.
㉯ 생체 내 흡수에 있어서의 의의
1) 순수한 물에서의 수용성은 생체 내 흡수라는 측면에서는 특별한 기술적 의의가 없음은 앞서 살펴본 바와 같다.
2) 이 사건 제3항 발명의 클로피도그렐 황산수소염은 인공위액에서의 수용성이 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염에 비하여 약 25배 우수하고 클로피도그렐 염산염에 비하여 약 1.3배 우수하므로 화학식(Ⅰ) 라세미체 염산염에 비하여는 양적인 차이가 현저하다.
그러나 ⓐ 을가 제33호증에는 클로피도그렐 황산수소염의 수용해도 7.42mg/ml 정도면 약학 조성물을 위장관액으로 용출시키는 데 아무런 지장이 없다는 기재가 있는 점, ⓑ 을가 제31호증(Guidance for Industry」미국보건복지부 식약청), 제32호증(WHO Technical Report Series)에는 약물의 최대 투여용량이 pH 1-7.5 범위에서 250ml 이하의 수성용매에 녹을 때 그 약물은 수용성이 높은 것으로 볼 수 있으며, 활성성분이 소장에서 흡수되는 데 문제가 없다는 기재가 있고, 이 사건 특허발명의 명세서에는 클로피도그렐 황산수소염의 활성성분 단위용량 최대치를 100mg으로, 일일용량 최대치로 500mg으로 각 제시하고 있는바, 표 Ⅰ에 기재된 클로피도그렐 유리염기에 대한 클로피도그렐 황산수소염의 중량비(2.5 ÷ 1.92 = 1.302)에 따라 위 최대용량을 클로피도그렐 황산수소염으로 환산한 값은 130mg(= 100mg × 1.302) 및 651mg(= 500mg × 1.302)이고, 이를 250ml에 용해시킬 경우의 수용해도를 계산해 보면, 0.52mg/ml(= 130mg ÷ 250ml) 및 2.6mg/ml(= 651mg ÷ 250ml)인데, 위에서 살펴본 인공위액(pH 1.2)에서의 라세미체 염산염의 용해도 28.8mg/ml는 일일 최대 투여량보다 10배나 많은 점(이는 영남대연구소의 1일 최대투여량 300mg을 2시간 동안 교반한 결과 pH 1.2의 용매에서, 클로피도그렐 황산수소염, 클로피도그렐 염산염뿐만 아니라 화학식(Ⅰ) 라세미체 염산염까지 모두 용해되었다는 실험결과와 일치하는 것이다)에 비추어 보면, 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염도 생체 내 흡수라는 측면에서 적절하고도 충분한 수용성을 가지므로, 이 사건 제3항 발명의 클로피도그렐 황산수소염이 가지는 인공위액에서의 수용성의 우수성은 특별한 기술적 의의가 없다.
그리고 인공장액에서의 수용성에 관하여 보면, 영남대연구소의 실험결과에 의하면, 클로피도그렐 황산수소염과 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염 모두 수용성이 1%를 넘지 못하므로, 이 사건 제3항 발명의 수용성이 현저하다고 볼 수 없다.
㉰ 기타 실험 등에 있어서의 의의
원고는 위 (마)1)①항에서 이 사건 제3항 발명의 물에서의 수용성은 동물실험에서 의의가 있다는 취지로 주장하나, 의약물질의 동물실험에 있어서도 결국, 생체 내에서의 흡수도가 중요하고, 물에서의 수용성은 중요하지 않을 것이므로{이 사건 특허발명의 명세서에서도, 동물실험을 위해 의약물질을 ‘에탄올’에 용해하고, 10%의 아라비아검이 함유된 ‘현탄액’을 사용했다(갑가 제2호증 제226면)}, 원고의 위 주장은 이유 없다.
⑥ 정 리
이 사건 제3항 발명의 클로피도그렐 황산수소염은, 비교대상발명 1의 클로피도그렐 염산염 및 화학식(Ⅰ) 라세미체 염산염에 비하여 물에서 다량 투여하였을 때의 수용성이 우수하나, 이는 의약품 제조에 있어서의 편리성이나 의약품의 생체 내 흡수에 있어서 특별한 기술적 의의가 없고(소량 투여시에 모두 용해된다 하더라도 마찬가지이다), 인공위액에서의 우수성도, 비교대상발명 1의 클로피도그렐 염산염 및 화학식(Ⅰ) 라세미체 염산염 역시 의약품의 원료물질로서 필요한 수용성을 충분히 가진다는 점에서 특별한 기술적 의의가 없으므로, 수용성에 있어서 효과의 현저성을 인정할 수 없다.
(바) 비흡습성에 관한 판단
① 당사자의 주장
㉮ 원고 주장의 요지
1) 클로피도그렐 황산수소염은 95%라는 극단적으로 높은 습도 조건에서 96시간 이상 수분 함량에 변화가 없으므로 비교대상발명 1에 비하여 비흡습성이 매우 우수하다.
2) 피고 가그룹 주장의 ‘75% 상대습도, 40℃에서 최소 6개월간 보관’이라는 조건은 ‘Drug Product’ 즉, 활성 성분에 여러 부형제와 첨가제를 추가하여 제조한 제품을 시판용 폐쇄 용기에 포장한 상태의 제형에 대해 안정성 시험을 수행할 때의 저장 조건이지 약제학적 조성물의 비흡습성을 측정하는 조건이 아니므로 아무런 의미가 없다.
3) 의약의 원료물질에 있어서는, 활성성분의 흡습성 정도에 따라 활성성분 원료의 취급 및 보관방법이 달라지기 때문에 비흡습성이 중요하고, 특히 클로피도그렐은 분자 구조 중의 메틸 에스테르기로 인하여 수분에 의하여 쉽게 가수분해되어 활성 의약품의 구조를 잃고 불순물로 변하는 성질이 있기 때문에, 활성물질에 대한 비흡습성 조건은 더욱 엄격하여 수분 함량이 0.5% ~ 1.0%를 넘을 수 없도록 요구하고 있으므로(미국약전, 유럽약전, 식약청 제출기준 및 시험방법), 비흡습성이 더욱 중요하다.
4) 이 사건 특허발명과 같은 약염기성 물질의 염은, 염이 가용한 수분에 대하여 완충작용을 하여 심각한 가수분해를 야기할 수 있고, 염산, 황산, 메실신과 같은 미네랄산에 의한 염은 높은 극성을 가지며, 약물의 결정표면에 노출되는 극성 이온화기는 젖음(wettability)을 좋아하는 강한 친수성 표면을 만들고 흡습을 야기시키는 경향이 있으므로, 통상적으로 흡습성이라고 예상되는 것인데, 비교대상발명 1에 구체적으로 개시되어 있는 화합물들에 비해서 비흡습성이거나 저흡성이라는 것은 예상할 수 없는 현저한 효과다.
5) 일반적으로 수용성이 높은 염이 흡습성이 크므로, 이 사건 특허의 우선성 광학이성질체가 수용성이 가장 높으면서도 흡습성은 가장 적다는 것은 이례적인 현상으로서 통상의 기술자가 용이하게 예측할 수 없다.
㉯ 피고 가그룹 주장의 요지
1) 이 사건 제3항 발명의 비흡습성을 입증하는 자료인 갑가 제8호증에는, 상대습도 95%에서는 96시간(4일간)에서만 흡습성을 측정했을 뿐, 그 이상의 기간에서는 흡습성을 측정하지 않았고, 유럽약전에 기재된 측정조건으로 이 사건 특허발명의 기술분야에서 통용되는 흡습성 분류기준인 ‘온도 조건 25±1℃, 상대습도 조건 80±2, 측정시간 24시간’에도 맞지 않으므로, 위 실험결과는 전혀 의미가 없는 것이다.
2) 특허공개공보 2005-0099445(을가 제1호증), 특허공개공보 2007-0094230(피고 가그룹 제출 참고자료 29)에는 이 사건 제3항 발명의 황산수소염이 흡습성이 우수하지 않다고 기재되어 있다.
3) 서울대연구소, 한국화학연구원, 영남대연구소, 이대연구소에서의 실험에서, 황산수소염은 라세미체와 우선성 광학이성질체 모두 흡습성이 적거나 없고, 염산염은 라세미체와 우선성 광학이성질체 모두 흡습성 아주 큰 것으로 나타났다.
4) 흡습성은 입자의 크기, 결정형, 온도조건, 습도조건에 따라 크게 좌우되므로, 이 사건 제3항의 클로피도그렐 황산수소염에 대하여 특정 결정형이나, 특정 조건에서의 흡습성 자료만으로는 흡습성의 우열을 가릴 수 없다.
5) 유럽약전에 의하면, 흡습성은 엄격히 해석될 필요가 없고 반드시 기재해야 하는 것도 아니며, 흡습성의 분류 자체가 대단히 광범위하고 강흡습성인 경우를 제외하고는 특별한 주의를 요하지 않는 참고사항에 불과하다. 그리고 ‘의약품 등 기준 및 심사의뢰서 심사규정’(을가 제14호증, 제6면)에 의하더라도, 원료 의약품의 용해도, 흡습성 등의 성상은 “사용할 때 식별사항 및 위급할 때 참고사항”에 해당하는 것이고, 이 중 흡습성은 별도의 기재를 요구하지도 않으며 “안정성(흡습성, 광안정성 등)”이라는 항목에 포함되는 것으로 규정하고 있으므로 비흡습성은 진보성 인정의 근거가 될 수 없다.
② 실험조건
을가 제34호증의 기재 및 변론 전체의 취지에 의하면, 이 사건 특허발명의 기술분야에서 통상의 기술자 사이에 의약품의 원료물질에 대한 흡습성 기준으로 사용되는 ‘유럽약전’에는, 흡습성의 측정조건으로 “...건조기의 온도 조건을 25±1℃로 맞추고 습도는 80±2 %상대습도로 고정한 후, 24시간 방치한다.”라고 기재되어 있고, 측정된 흡습성 결과에 대한 분류기준으로, ‘  조해성(deliquescent) : 물을 흡수해서 액체가 됨,
조해성(deliquescent) : 물을 흡수해서 액체가 됨,  매우 흡습성(very hygroscopic) : 질량 증가율이 15% 이상, ⓒ 흡습성 (hygroscopic): 질량 증가율이 2% 이상 15% 미만, ⓓ 약간흡습성(slightly hygroscopic) : 질량 증가율 0.2% 이상 2% 미만’의 4등급으로 나누고 있으므로, 위 기준에 상응하는 실험결과에 의하여 이 사건 제3항 발명의 물질이 비교대상발명 1의 물질에 비하여 우수한 비흡습성을 가지는지에 관하여 살펴본다.
매우 흡습성(very hygroscopic) : 질량 증가율이 15% 이상, ⓒ 흡습성 (hygroscopic): 질량 증가율이 2% 이상 15% 미만, ⓓ 약간흡습성(slightly hygroscopic) : 질량 증가율 0.2% 이상 2% 미만’의 4등급으로 나누고 있으므로, 위 기준에 상응하는 실험결과에 의하여 이 사건 제3항 발명의 물질이 비교대상발명 1의 물질에 비하여 우수한 비흡습성을 가지는지에 관하여 살펴본다.
③ 실험결과
원고가 이 사건 제3항 발명의 비흡습성을 입증하기 위하여 제출한 자료 중 유럽약전의 실험조건에 부합하는 갑나 제7호증(서울대연구소의 2007. 8. 20.자 1차 보고서), 을나 제41호증(한국화학연구원의 실험결과)에 의하면 다음과 같다.
| ? | 조건 | 라세미체 염산염(수분증가율 %) | 클로피도그렐 (수분증가율 %) | |
| 염산염 | 황산수소염 | |||
| 서울대연구소 | 25℃, 82%, 24시간 | 6 | 4.8 | 0.3 |
| 흡습성 | 흡습성 | 약간흡습성 | ||
| 한국화학연구원 | 25℃, 80%, 24시간 | 1.1 | 1.4 | 0.0 |
| 약간흡습성 | 약간흡습성 | 비흡습성 | ||
(서울대연구소의 실험결과는 그래프의 변화를 적절한 수치로 변환한 것으로서 약간의 오차는 있을 수 있다)
④ 판 단
가) 이 사건 제3항 발명의 클로피도그렐 황산수소염과 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염을 대비하면, 비흡습성 또는 약간 흡습성 : 약간 흡습성 또는 흡습성으로서, 유럽약전이 분류하고 있는 4단계의 흡습성 등급 중 1등급 차이에 불과하고, 특히 한국화학연구원의 실험결과에 의하면, 양자 모두 위 분류등급 중 최상의 등급(2% 미만)에 속하므로, 우선 양적으로 현저한 차이가 있다고 할 수 없다.
나) 흡습성(hygroscopy)이란 공기 중의 수분(습기)이 분말 의약품에 흡수되어 일어나는 일종의 흡착현상 혹은 용해현상으로서, 의약품이 수분을 흡수하는 경우 의약품의 물질의 구조에 따라 가수분해되기도 하고, 액화해서 유동성(유동성)의 약화, 고결(고결), 착색 등 취급상의 문제점, 보관상의 문제점 등 물리화학적 안정성에 문제를 야기할 수 있다. 또한, 분말의 원료물질을 정제로 제조하는 공정에서는 어느 정도 수분이 있어야만 결합력도 향상되어 성형을 용이하게 하기도 하나, 지나치게 흡습한 경우에는 정제가 굳어질 수도 있으며, 수분이 너무 부족한 경우는 오히려 무르거나 부스러지는 등의 흡습성의 정도에 따라 여러 가지 문제점을 야기할 수도 있다. 그리고 정제 등 의약품 제제의 제조공정은 대부분 여러 단계를 거치게 될 뿐 아니라 특정 단계에서는 건식공정, 습식공정 중 하나를 선택하기도 하는 것이어서, 일반적으로 낮은 흡습성이 요구되나, 어느 정도의 낮은 흡습성이 제조공정상 최적의 효과를 가져오는지에 대한 일률적 기준은 설정하기 어렵다(변론 전체의 취지, 피고 가그룹 제출 참고자료 45 제284면, 제291면 참고).
제제공정에 있어서의 위와 같은 흡습성의 특성 때문에, 유럽약전도 흡습성의 측정조건과 분류기준을 정하고 있지만 이를 반드시 기재하여야 하는 항목으로 규정하고 있지는 않으며(을가 제34호증), 약사법의 식품의약품안전청고시에 해당하는 ‘의약품 등 기준 및 시험방법 심사의뢰서 심사규정’(을가 제14호증)도 제5조의 원료 의약품의 기준 및 시험방법 작성요령에서 흡습성에 대하여는 별도의 항목을 정하지 않고 ‘사용할 때 식별사항 및 취급할 때 참고사항’에 “안정성(흡습성, 광안정성 등)을 기재한다.”라고만 규정하여, 흡습성을 참고사항에 해당하는 안정성 항목에 포함시키고 있다. 그리고 ‘의약품 등의 안정성시험기준’(을가 제15호증)에도 흡습성에 대한 시험기준은 제시되어 있지 않고, “안정성(흡습성)”의 시험기준만 제시되어 있다.
위와 같은 사정에 비추어 보면, 클로피도그렐 황산수소염과 클로피도그렐 염산염, 화학식(Ⅰ) 라세미체 염산염은 모두 의약품의 원료물질로서 적절하고도 충분한 정도의 비흡습성을 가지고 있으므로, 양자 사이의 위와 같은 비흡습성의 차이는 제제학적 의의가 크다고 할 수 없다.
다) 따라서 이 사건 제3항 발명은 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염에 비하여 비흡습성이 어느 정도 우수한 점은 인정되나, 그 차이가 크지 아니할 뿐만 아니라 특별한 기술적 의의가 없으므로, 비흡습성에 있어서 효과의 현저성을 인정할 수 없다.
(사) 정 리
이 사건 특허발명의 출원 후에 실시된 실험결과에 의하여 인정되는 이 사건 제3항 발명의 제제학적 효과는, 이 사건 특허발명의 명세서에 기재되어 있지 않고, 통상의 기술자가 명세서를 통해 예측할 수도 없어 진보성 판단에 있어서 제3항 발명의 효과로 인정할 수 없을 뿐만 아니라, 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염에 비하여 양적으로 큰 차이가 없거나, 양적인 차이가 있는 경우에도 제제학적 의의를 인정할 수 없으므로, 비교대상발명 1에 비하여 현저한 효과를 인정할 수 없다.
다. 소결론
이 사건 제3항 발명은 비교대상발명 1에 구체적으로 개시되어 있지 아니하여 그 신규성을 부정할 수 없으나, 비교대상발명 1에 비하여 효과의 현저성이 인정되지 아니하여 그 진보성을 인정할 수 없으므로 그 등록이 무효로 되어야 한다.
9. 이 사건 제4·5항 각 발명에 관한 판단
가. 당자사의 주장
(1) 원고 주장의 요지
이 사건 제4·5항 각 발명은 비교대상발명 1에 구체적으로 개시되어 있지 아니하며, 약리효과, 독성효과 및 제제학적 효과에 있어 현저히 우수하므로, 신규성 및 진보성이 인정된다.
(2) 피고들 주장의 요지
(가) 비교대상발명 1의 실시예 10에 개시된 라세미체 브롬산염은 우선성 광학이성질체의 브롬산염과 좌선성 광학이성질체의 브롬산염의 혼합물이고, 그 우선성 광학이성질체는 이 사건 제4항 발명의 클로피도그렐 브롬산염과 비교하여, R이 -CH₂CH₃로서 탄소수 1개만 다른 것으로서 실질적으로 동일한 범주에 속하므로, 비교대상발명 1에 구체적으로 개시된 것으로서 신규성이 인정되지 않는다.
(나) 이 사건 제4항 발명인 클로피도그렐의 브롬산염과 이 사건 제5항 발명인 클로피도그렐의 타우로콜린산염은 비교대상발명 1에 공지된 화학식(Ⅰ)의 라세미체 염산염과 클로피도그렐 염산염에 비하여 약리효과, 독성효과가 우수하지 않고, 명세서에 제제학적 효과의 우수성에 관한 기재가 없어 진보성 판단에 있어 발명의 효과로 인정할 수 없으며, 실험조건에 따라 우수한 결과가 나타나는 경우에도 제제학적 의의가 없는 것이므로 진보성을 인정할 수 없다.
나. 이 사건 제4항 발명의 신규성에 관한 판단
(1) 문언적 개시의 여부
갑가 제5호증의 기재에 의하면, 비교대상발명 1의 실시예에는 일반식(Ⅰ)에 포함되는 21종의 화합물의 제조예가 구체적으로 기재되어 있고, 그 중 화학식(Ⅰ) 라세미체에 해당하는 R이 CH₃이고, X가 2-Cl인 화합물의 염산염은 기재되어 있으나(실시예 1, 유도체번호 1), 나아가 클로피도그렐 브롬산염 또는 화학식(Ⅰ) 라세미체의 브롬산염은 명시적으로 기재되어 있지 않다.
그리고 비교대상발명 1의 명세서에는 일반식(Ⅰ)의 화합물 중 Y가 OH, OR 등으로, X는 수소, 할로겐 또는 저급알킬기 등으로 정의되어 있고, Y가 OR인 경우에는 약제학적으로 허용되는 무기 또는 유기산과의 부가염을 형성할 수 있다는 취지로 기재되어 있으면서도, 위 치환기들 중에서 바람직한 것이 어느 것이고 특정 치환기에 적합한 무기 또는 유기산은 어떤 것인가에 대한 기재는 전혀 없으므로 묵시적으로 클로피도그렐 브롬산염 또는 화학식(Ⅰ) 라세미체의 브롬산염이 개시되어 있다고 볼 수도 없다.
(2) 실질적 개시 여부
피고 가그룹은 이 사건 제3항 발명의 클로피도그렐 브롬산염은 비교대상발명 1의 일반식(Ⅰ) 라세미체 브롬산염과 실질적으로 동일한 물질이므로 비교대상발명 1에 실질적인 개시가 있다는 취지의 주장을 하므로 살피건대, 비교대상발명 1의 명세서에는 이 사건 제4항 발명인 클로피도그렐 브롬산염과 가장 근사한 화합물로는 치환기 R이 CH₂-CH₃이고 X가 2-Cl인 화합물(실시예 10)이 기재되어 있을 뿐인데, 이는 이 사건 제4항 발명의 클로피도그렐 브롬산염과 비교하여 모핵은 동일하고, 치환기(R)만이 메틸기 대신 에칠기로 대체된 것으로서 클로피도그렐 브롬산염과는 탄소수 1개의 차이가 있다. 그러나 비교대상발명 1의 혈소판 응집저해 작용 및 항혈전 작용에 관한 실험결과에 의하면, 아래 표에서 보는 바와 같이, 모핵이 동일하고 치환기의 탄소수 1개 차이밖에 없는 화학식(Ⅰ) 라세미체 염산염(유도체번호 1)과 비교대상발명 1의 라세미체 브롬산염 사이에는 약리효과에 있어서 상당한 차이를 보이므로, 모핵이 동일하고 치환기에 탄소수의 차이가 1개밖에 차이가 없다고 하여 실질적으로 동일한 물질이라고 볼 수 없다.
| [표 1] ADP에 의해 유도되는 혈소판 응집작용 억제 효과 | ||
| 생성물 | 투여용량 mg/kg | 응집되지 않은 혈소판의 비율(%) |
| 유도체번호 1 | 3×25 | 94±3 |
| 유도체번호 10 | 3×25 | 66±2 |
| [표 2] 초기응집률 | ||
| 생성물 | 투여용량 mg/kg | 초기응집률 |
| 유도체번호 1 | 3×25 | 0.14±0.03 |
| 유도체번호 10 | 3×25 | 0.16±0.07 |
| [표 4] 항-혈전 작용 | ||
| 생성물 | 투여용량 mg/kg | 혈전중량(mg) |
| 유도체번호 1 | 3×25 | 6.56±0.51 |
| 유도체번호 10 | 3×200 | 5.89±0.99 |
따라서 이 사건 제4항 발명의 클로피도그렐 브롬산염은 비교대상발명 1에 개시된 일반식(Ⅰ) 화합물의 라세미체 브롬산염과 실질적으로 동일한 물질이라고 보기 어려우므로, 비교대상발명 1에 의하여 실질적으로도 개시되었다고 볼 수 없다.
(3) 정 리
따라서 이 사건 제4항 발명은 비교대상발명 1에 문언적 또는 실질적으로 개시되어 있지 아니하므로, 비교대상발명 1에 의하여 그 신규성을 부정할 수 없다.
다. 이 사건 제4·5항 각 발명의 진보성에 관한 판단
(1) 판단 기준
이 사건 특허발명의 명세서 기재에 의하면, 이 사건 제4·5항 각 발명은 제3항 발명과 같이 클로피도그렐이 갖는 약리효과와 독성효과를 그대로 가지면서, 결정성, 수용성, 비흡습성 등 제제학적 효과를 추가적으로 갖는 것이다.
따라서 위 제8의 나. (1)항 및 (2)항에서 살펴본 바와 같이, 이 사건 제4·5항 각 발명의 진보성이 인정되기 위하여는 약리효과, 독성효과, 제제학적 효과 중 일부라도 비교대상발명 1에 구체적으로 개시되어 있는 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염과 대비하여 ‘특별하고도 현저한 효과’가 인정되어야 한다.
(2) 약리효과에 관한 판단
(가) 이 사건 제4항 발명
이 사건 특허발명의 명세서에는 클로피도그렐 브롬산염(SR 25990D)의 혈소판 응집저해 작용 및 항혈전 작용과 관련된 실험결과가 전혀 기재되어 있지 아니하여, 이 사건 제4항 발명이 비교대상발명에 비하여 어느 정도 효과가 있는지 확인할 수 없고, 달리 이를 인정할 증거가 없으므로, 약리효과에 있어 이 사건 제4항 발명의 현저성을 인정할 수 없다.
(나) 이 사건 제5항 발명
이 사건 특허발명의 명세서에 기재된 실험결과(아래 표 참조)에 의하면, 이 사건 제5항 발명의 클로피도그렐 타우로콜린산염의 혈소판 응집저해 작용 및 항혈전 작용은 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염에 비하여 같은 양의 염기가 투여되었을 때 1 ~ 1.6배 우수함을 알 수 있다.
그러나 위 제8의 나.(3)항에서 살펴본 바와 같이, 클로피도그렐 타우로콜린산염이 화학식(Ⅰ) 라세미체 염산염에 비하여 2배 정도 우수한 약리효과를 보이는 것은 라세미체와 광학이성질체 사이의 관계에 비추어 통상의 기술자가 예측할 수 있는 범위에 속하므로, 이 사건 제5항 발명 클로피도그렐 타우로콜린산염의 현저한 효과를 인정할 수 없다.
| [표 Ⅱ] 콜라겐에 의해 유도되는 혈소판 응집작용 억제 효과 | |||
| 생성물 | 투여된 염기 | %저해 | P |
| 라세미체 염산염(PCR 4099) | 3.84 | 25 | 0.05 |
| 7.69 | 44 | 0.01 | |
| 클로피도그렐 타우로콜린산염(SR 25990E) | 3.84 | 40 | 0.05 |
| 7.69 | 66 | 0.01 | |
| [표 Ⅲ] 혈전 억제 효과 | |||
| 생성물 | 염기의 양 | 편차 | P |
| 라세미체 염산염 | 3.84 | 44 | 0.001 |
| 7.69 | 64 | 0.001 | |
| 15.38 | 74 | 0.001 | |
| 클로피도그렐 타우로콜린산염 | 3.84 | 56 | 0.001 |
| 7.69 | 67 | 0.001 | |
| 15.38 | 69 | 0.001 | |
(3) 독성효과와 치료계수
(가) 이 사건 제4항 발명
이 사건 특허발명의 명세서 표 Ⅳ에 의하면, 이 사건 제4항 발명의 클로피도그렐 브롬산염(CSR 25990D)의 LD50은 4268인데 비하여, 비교대상발명 1의 클로피도그렐 염산염(SR 25990A)의 LD50은 4316이므로, 이 사건 제4항 발명이 저독성에 있어 우수하다고 할 수 없다.
그리고 화학식(Ⅰ) 라세미체의 염산염(PCR 4099)의 LD50은 1615이므로 클로피도그렐 브롬산염이 약 2.6배 정도 저독성임을 알 수 있으나, 클로피도그렐 브롬산염이 약리효과에 있어 화학식(Ⅰ) 라세미체 염산염에 비하여 어느 정도 우수한지 알 수 없으므로, 약리효과와 밀접한 관련이 있는 독성효과에 있어 약 2.6배 정도 우수하다는 점만으로는 효과의 현저성을 인정할 수 없다.
(나) 이 사건 제5항 발명
이 사건 특허발명의 명세서에는 클로피도그렐 타우로콜린산염(SR 25990E)의 급성독성과 관련된 실험결과가 전혀 기재되어 있지 아니하여, 이 사건 제5항 발명이 비교대상발명에 비하여 어느 정도 효과가 있는지 알 수 없고, 달리 이를 인정할 증거가 없으므로, 독성효과에 있어 이 사건 제5항 발명의 현저성을 인정할 수 없다.
(4) 제제학적 효과에 관한 판단
(가) 현저한 효과의 명세서 기재 여부
위 제8.의 나.(5) (다)항에서 살펴본 바와 같이, 이 사건 특허발명의 명세서에는 이 사건 제4·5항 각 발명의 제제학적 효과에 관하여, 비교대상발명 1이 가지는 동질의 효과에 비하여 양적으로 현저하게 우수하다는 점을 알 수 있도록 기재되어 있지 아니하므로, 원고가 주장하는 제제학적 효과의 우수성은 발명자가 인식하고 완성한 효과의 범위를 넘는 것이어서, 이 사건 제4·5항 각 발명의 효과로 인정할 수 없으나, 아래에서는 보충적으로 이 사건 제4·5항 각 발명의 제제학적 효과가 비교대상발명 1에 비하여 현저한 것인지 살펴본다.
(나) 결정성에 관한 판단
이 사건 제4·5항 각 발명의 클로피도그렐 브롬산염과 타우로콜린산염이 갖는 결정성 관련 효과는 정제하기 어려운 오일상 물질인 클로피도그렐 유리염기를 결정화함으로써 약제학적 조성물을 제조하기 쉽게 하였다는 것이나, 비교대상발명 1에도 실시예로 제조한 화합물이 오일상일 경우 이를 정제시켜 ‘백색결정’을 형성함으로써 동일한 효과를 얻게 되었으므로, 이 사건 제4·5항 각 발명이 비교대상발명 1에 비하여 '특별하고도 현저한 효과'를 가진다고 볼 수 없다.
(다) 수용성에 관한 판단
① 실험결과
가) 물에서의 수용성(갑나 제7호증, 을나 제41호증)
| 단위(mg/ml) | 클로피도그렐 라세미체 염산염 | 클로피도그렐 염산염 | 클로피도그렐 브롬산염 | 클로피도그렐 타우로콜린산염 |
| 서울대연구소 | 23.88±0.68 | 162.82±14.41 | 33.14±1.43 | 48.47±3.73 |
| 한국화학연구원 | 27.8 | 162.8 | 43.7 | ? |
나) 인공위액과 장액에서의 수용성(을가 제27·28호증)
| ? | 인공장액(pH6.8)(mg/ml) | 인공위액(pH1.2)(mg/ml) |
| 라세미체 염산염 | 0.12 | 28.8 |
| 클로피도그렐 염산염 | 0.12 | 535 |
| 클로피도그렐 브롬산염 | 0.13 | 49 |
(이대연구소 시험보고서)
| ? | ? | 인공장액(pH6.8) | 인공위액(pH1.2) | ||
| 라세미체 | 유리염기 | 5.43(ug/ml) | 0.44(%) | 1255(ug/ml) | 103.2(%) |
| 염산염 | 6.39 | 0.53 | 1243 | 102.9 | |
| 클로피도그렐 | 염산염 | 4.5 | 0.37 | 1247 | 102.8 |
| 브롬산염 | 4.36 | 0.36 | 1245 | 103.1 | |
(영남대연구소 최종보고서)
② 판 단
가) 이 사건 제4·5항 각 발명의 물에서의 수용성은 비교대상발명 1의 클로피도그렐 염산염 비하여 오히려 열등하고, 비교대상발명 1의 라세미체 염산염에 비하여 약 1.4배 ~ 2배 정도 우수하나, 위 제8.의 나.(5) (마)항에서 살펴본 바와 같이, 의약품 원료물질의 물에서의 수용성은 의약품 제조에 있어서의 편리성이나 의약품의 생체 내 흡수에 있어서 특별한 기술적 의의가 없다.
나) 이 사건 제4항 발명의 인공위액에서의 수용성 역시 비교대상발명 1의 화학식(Ⅰ) 라세미체 염산염 및 클로피도그렐 염산염에 비하여 우수하나, 위 제8의 나.(5)(마)항에서 살펴본 바와 같이, 양 발명의 물질들 모두가 발명의 목적에 비추어 필요한 용해도를 모두 충족하므로 생체 내 흡수라는 측면에서는 아무런 의의가 없다. 그리고 인공 장액에서는 비교대상발명 1의 물질들과 수용성의 정도가 비슷하여 현저하다고 볼 수 없다.
다) 따라서 이 사건 제4·5항 각 발명은 비교대상발명 1에 비하여 수용성이 현저하게 우수하다고 볼 수 없다.
(라) 비흡습성에 관한 판단
① 실험결과
| ? | 조건 | 화학식(Ⅰ) 라세미체 염산염 (수분증가율 %) | 클로피도그렐 (수분증가율 %) | ||
| 염산염 | 브롬산염 | 타우로콜린산염 | |||
| 서울대연구소 | 25℃, 82%, 24시간 | 6 | 4.8 | 6 | 8.5 |
| 흡습성 | 흡습성 | 흡습성 | 흡습성 | ||
| 한국화학연구원 | 25℃, 80%, 24시간 | 1.1 | 1.4 | 0.3 | ? |
| 약간 흡습성 | 약간 흡습성 | 약간 흡습성 | ? | ||
(서울대연구소의 실험결과는 그래프의 변화를 적절한 수치로 변환한 것으로서 약간의 오차는 있을 수 있다)
② 판 단
위 실험결과에 의하면, 이 사건 제4항 발명의 클로피도그렐 브롬산염 및 제5항 발명의 타우로콜린산염과, 비교대상발명 1의 라세미체 염산염 및 클로피도그렐 염산염의 흡습성은 모두 유럽약전 기준으로 동일한 등급(흡습성 또는 약간 흡습성)이므로, 이 사건 제4·5항 각 발명의 비흡습성에 관한 효과의 현저성을 인정할 수 없다.
(마) 정 리
이 사건 제4·5항 각 발명은 비교대상발명 1에 비하여 제제학적 효과의 현저성을 인정할 수 없다.
라. 소결론
이 사건 제4·5항 각 발명은 비교대상발명 1에 구체적으로 개시되어 있지 아니하여 신규성을 부정할 수 없으나, 비교대상발명 1에 비하여 현저한 효과가 인정되지 아니하여 진보성은 부정되므로, 그 등록이 무효로 되어야 한다.
10. 이 사건 제6 내지 9항 각 발명에 관한 판단
가. 이 사건 제6항 발명의 신규성 및 진보성 여부
(1) 이 사건 제6항 발명과 비교대상발명들의 내용
이 사건 제6항 발명은 클로피도그렐의 제조방법에 대한 것인데, 이는 ① 용매 중에서 광학적으로 활성인 산과 화학식(Ⅰ)의 라세미체의 염을 형성하는 단계, ② 일정한 광학적 회전력을 갖는 생성물이 얻어질 때까지 그 염의 재결정화를 반복하는 단계, ③ 염기에 의해 염으로부터 우선성 광학이성질체를 유리시키는 단계로 구성된 것이다.
비교대상발명 2는 라세미체를 분리 또는 분할하여 광학활성 물질을 얻는 방법에 관한 것인데, 염-형성 산-염기 반응은 대다수의 경우를 만족시키는 광학적 분할방법으로서 중요하다는 점과(을가 제2호증, 제2725면 왼쪽 컬럼 제18∼23행), 아민기를 갖는 화합물의 분할제로서 캄포-10-설폰산, 3-브로모캄프-9-설폰산 등이 개시되어 있으며{을가 제2호증, 제2729면의 〈표 4〉}, α-(2-티아나프테닐)-프로피온산을 분할하기 위한 예비 실험에서 용매로서 아세톤을 사용한 결과가 기재되어 있다{을가 제2호증, 제2726면 〈표 1〉}.
비교대상발명 3은 비대칭 탄소를 가지고 있어 광학이성질체로 존재할 수 있는 벤조티아진 유도체의 제조방법에 관한 것인데, 그 발명의 상세한 설명의 기재에 따르면, 위 광학이성질체는 라세미체를 광학 분할하는 통상의 방법, 즉 ① 캄포설폰산 또는 디벤조일 타르타르산과 같은 임의 활성 산과의 염을 형성하고, ② 적절한 용매로 선택적으로 결정화함으로써 각각의 에난티오머로 분리할 수 있다는 취지의 기재가 있다(을나 제3호증, 제703면 좌측하단 컬럼 6∼우측하단 컬럼 4행).
(2) 이 사건 제6항 발명과 비교대상발명 2·3의 대비
이 사건 제6항 발명은 클로피도그렐이라는 물질의 제조방법에 대한 발명이므로, “원료물질, 처리수단 및 목적물질”이라는 3가지 구성요소로 이루어져 있는바, 이 사건 제6항 발명과 비교대상발명 3을 대비하면, 이 사건 제6항 발명은 화학식(Ⅰ) 라세미체로부터 그의 우선성 광학이성질체인 클로피도그렐을 광학분할하는 방법인 데 비하여, 비교대상발명 3은 벤조티아진 유도체의 라세미체로부터 그의 광학이성질체의 어느 하나를 광학분할하는 방법이라는 점에서 원료물질과 목적물질에는 차이가 있으나, 그 처리수단은 용매 중에서 광학적으로 활성인 산과 라세미체의 염을 형성한 후, 염의 재결정화를 반복함으로써 목적하는 광학이성질체를 수득하는 방법이라는 점에서는 아무런 차이가 없다.
그렇다면 이 사건 제6항 발명은 그 라세미체로부터 클로피도그렐을 제조하기 위해, 그 특허출원 전 라세미체로부터 광학이성질체를 분리하는 공지의 방법인 비교대상발명 2 및 3의 방법을 그대로 적용한 것에 불과하므로, 특별한 사정이 없는 한, 그 기술적 의의를 인정할 수 없다.
(3) 원고의 주장에 관한 판단
(가) 원고는, 이 사건 제6항 발명은 제1항 발명의 클로피도그렐의 제조방법에 관한 것이므로, 그 목적 물질인 클로피도그렐의 특허성이 인정되는 한, 그 제조방법의 특허성도 당연히 인정된다고 주장하므로 살피건대, 이 사건 제1항 발명의 신규성 및 진보성 여부에서 살펴본 바와 같이, 이 사건 제6항 발명의 목적물질인 클로피도그렐은 비교대상발명 1에 의하여 공지된 것이어서 그 특허성이 인정될 수 없으므로, 원고의 위 주장은 이유 없다.
(나) 원고는 또, 이 사건 특허발명의 출원 전에 라세미체를 분리하는 방법에는, 효소적 비대칭 합성, 화학 비대칭 합성, 비대칭 액체 크로마토그래피, 비대칭 용매로의 추출 등 다양한 방법이 공지되어 있으나, 위와 같은 많은 방법들 중에서 어느 방법을 선택해야 이 사건 특허발명의 화합물인 클로피도그렐을 제조할 수 있는지는 실제 실험을 하기 전까지는 알 수 없고, 라세미체를 분리하는 일반적인 방법에 대한 기재만 있는 비교대상발명 2·3으로부터 이 사건 제6항 발명의 제조방법을 선택하는 것에 곤란성이 있다고 주장한다.
살피건대, 화학식(Ⅰ) 라세미체로부터 광학이성질체를 분리하는 방법을 선택하는 데 기술적 곤란성이 있다고 하기 위해서는, 이 사건 제6항 발명의 분리방법이 비록 공지되었다 하더라도 일반적으로 사용되지 않거나 화학식(Ⅰ) 라세미체의 특수한 구조로 인하여 통상의 기술자라면 위와 같은 분리방법을 사용하지 않을 것이라는 점이 인정되어야 할 것이나, 을가 제4·5호증, 을나 제14·15호증의 각 기재에 의하면, 이 사건 제6항 발명의 광학이성질체 분리방법은 널리 알려진 방법임을 알 수 있으므로, 원고의 위 주장은 이유 없다.
(4) 대비결과
이 사건 제6항 발명은 비교대상발명 2·3으로부터 통상의 기술자가 용이하게 발명할 수 있는 것이므로, 그 진보성이 인정되지 않는다.
나. 이 사건 제7항 내지 제9항 각 발명의 신규성 및 진보성 여부
(1) 이 사건 제7항 내지 제9항 각 발명은 제6항 발명의 기술적 구성을 보다 구체적으로 한정하는 종속항인데, 제7항 발명은 염 형성제인 광학활성 산으로 좌선성 캄퍼-10-설폰산을, 제8항 내지 제9항 발명은 각각 재결정화 용매 및 염 형성 용매로서 아세톤을 한정한 것이다.
그런데 비교대상발명 2에는 아민기를 갖는 화합물의 분할제, 즉 염 형성제로서 캄포-10-설폰산을 용매로서 아세톤을 사용하는 것이 개시되어 있으므로, 이 사건 제7항 내지 제9항 발명은 공지의 기술에 지나지 않다.
(2) 이에 대하여 원고는, 이 사건 특허발명의 출원 전에 수많은 광학분할제들이 사용되고 있고, 비교대상발명 2, 3에 그 중에서 바람직하거나 클로피도그렐에 적용될 수 있는 광학분할제를 개시하고 있는 것이 아니므로, 클로피도그렐을 분리하기 위한 분할제와 용매를 선택함에 있어 곤란성이 있다고 주장하므로 살피건대, 앞서 살펴본 바와 같이 비교대상발명 2 및 3뿐만 아니라 을가 제4·5호증, 을나 제14·15호증의 각 기재에 의하면, 이 사건 특허발명 출원 전 당해 기술분야에서는 염 형성제인 광학활성 산으로 좌선성 캄퍼-10-설폰산과, 재결정화 용매 및 염 형성 용매로서로서 아세톤이 널리 사용되는 물질임을 알 수 있으므로, 원고의 위 주장은 이유 없다.
(3) 따라서 이 사건 제7항 내지 제9항 각 발명은 비교대상발명 2, 3으로부터 당해 기술분야에서 통상의 지식을 가진 자가 용이하게 발명할 수 있는 것이므로, 그 진보성을 인정할 수 없다.
11. 이 사건 제10·11항 각 발명에 관한 판단
가. 이 사건 제10항 발명
(1) 당사자의 주장
(가) 원고 주장의 요지
① 비교대상발명 1에는 어떤 화합물에 대해서도 광학이성질체를 분리하여 광학 활성을 확인한 적도 없고, 광학이성질체의 정확한 분리 방법에 대해서 개시하거나, 분리된 광학이성질체의 약리활성을 확인하여 기재하지 아니하였으며, 라세미체와 광학이성질체 사이에 효과의 차이가 있을 가능성에 대하여 시사하는 기재도 없으므로, 비교대상발명 1은 이 사건 특허발명의 우선성 광학이성질체의 용도를 구체적으로 개시한 것이라고 할 수 없다.
② 이 사건 제10·11항 각 발명의 조성물의 활성 성분인 클로피도그렐은 공지된 라세미체에 비하여 혈소판 응집 저해 활성 및 항혈전 작용이 우수하면서도 라세미체에 비해 독성이 적고 라세미체와는 달리 경련과 같은 심각한 부작용을 나타내지 않아 장기투여가 필요한 혈소판 질환의 치료제로서 라세미체에 비해 현저히 우수한 효과를 가진다.
③ 통상의 기술자가 단순한 반복실험으로 광학이성질체의 현저한 효과를 확인할 수 있다는 사정만으로 그 효과의 현저함을 부인할 수 없다.
(나) 피고들 주장의 요지
이 사건 제10항 발명은 의약의 용도발명인데, 의약물질로 제시된 제1항 발명의 화합물과 그 치료용도가 모두 비교대상발명 1에 개시되어 있으므로, 신규성을 인정할 수 없다.
(2) 이 사건 제10항 발명과 비교대상발명 1의 대비
(가) 이 사건 제10항 발명은, “혈소판 응집 저해작용을 가지는 클로피도그렐 및 그 약제학적으로 허용되는 염(제1항 발명의 화합물)을 함유하는 것을 특징으로 하는 혈소판 질환의 치료 및 예방에 유효한 약제학적 조성물”에 관한 것이고, 비교대상발명 1은, “일반식(Ⅰ)의 화합물 및 약제학적으로 허용되는 담체를 함유하는 혈소판 응집 억제 활성 및 항 혈전 활성을 갖는 치료 조성물”에 관한 것이다.
따라서 양 발명은 모두 의약용도발명으로서 일반식(Ⅰ)에 해당하는 물질을 대상으로 하고, 용도가 모두 혈소판 응집 억제 활성 및 항혈전 활성을 통해 혈소판 질환의 치료에 있다는 점에서 동일하며, 다만 이 사건 제10항 발명의 대상 물질인 클로피도그렐은 비교대상발명 1의 대상물질로서 상위개념으로 기재된 일반식(Ⅰ)의 하위개념에 해당하는 물질이라는 점에서 차이가 있으므로, 이 사건 제10항 발명은 비교대상발명 1과의 관계에서 선택발명에 해당한다.
(나) 앞서 살펴본 바와 같이, 이 사건 제10항 발명이 선택발명으로서 특허성을 부여받기 위해서는, 첫째 선행발명이 선택발명을 구성하는 하위개념을 구체적으로 개시하지 않고 있으면서(신규성 요건), 둘째 선택발명에 포함되는 하위개념들 모두가 선행발명이 갖는 효과와 질적으로 다른 효과를 갖고 있거나, 질적인 차이가 없더라도 양적으로 현저한 차이가 있는 경우(진보성 요건)에 해당하여야 한다.
(3) 신규성에 관한 판단
(가) 비교대상발명 1은 일반식(Ⅰ)에 해당하는 물질 중 화학식(Ⅰ)의 라세미체를 구체적으로 개시하고 있고, 모든 라세미체에 대하여 “그 각각의 에난티오머”까지 구체적으로 인식하고 발명의 대상으로 삼은 것임은 위 제6.의 다.항에서 살펴본 바와 같다. 그리고 비교대상발명 1의 명세서에는 의약물질의 용도로서 혈소판 응집저해 작용 및 항혈전 작용이 기재되어 있을 뿐만 아니라 화학식(Ⅰ) 라세미체 염산염의 약리효과에 대한 구체적인 실험 데이터도 기재되어 있다.
(나) 이에 대하여 원고는, 비교대상발명 1에는 화학식(Ⅰ)의 라세미체만 개시되어 있을 뿐, 클로피도그렐을 분리하여 구체적으로 실험한 결과가 기재되어 있지 아니하므로, 클로피도그렐의 용도에 관한 구체적인 개시가 없다고 주장한다.
살피건대, 의약의 용도발명에 있어서는 그 출원 전에 명세서 기재의 약리효과를 나타내는 약리기전이 명확히 밝혀진 경우와 같은 특별한 사정이 있지 않은 이상, 특정 물질에 그와 같은 약리효과가 있다는 것을 약리데이터 등이 나타난 시험 예로 기재하거나 또는 이에 대신할 수 있을 정도로 구체적으로 기재하여야만 비로소 발명이 완성되었다고 볼 수 있는 동시에 명세서의 기재요건을 충족하였다고 볼 수 있는바( 대법원 2003. 10. 10. 선고 2002후2846 판결 , 대법원 2004. 12. 23. 선고 2003후1550 판결 등 참조), 비교대상발명 1의 명세서에 클로피도그렐의 혈소판 응집저해 작용 및 항혈전 작용에 대한 약리데이터 또는 구체적 실험결과가 기재되어 있지 아니하므로, 클로피도그렐에 대한 의약용도발명은 미완성이라 볼 여지도 있다.
그러나 출원발명의 진보성 판단에 제공되는 선행기술은 기술 구성 전체가 명확하게 표현된 것뿐만 아니라, 자료의 부족으로 표현이 불충분하거나 일부 내용에 흠결이 있다고 하더라도 그 기술분야에서 통상의 지식을 가진 자가 기술상식이나 경험칙에 의하여 쉽게 기술내용을 파악할 수 있는 범위 내에서는 대비대상이 될 수 있다( 대법원 2000. 12. 8. 선고 98후270 판결 , 대법원 2003. 12. 26. 선고 2001후2702 판결 , 대법원 2006. 3. 24. 선고 2004후2307 판결 등 참조).
그런데 비교대상발명 1은 그 명세서에 화학식(Ⅰ)의 라세미체 염산염과 그 용도를 구체적으로 기재하고, 라세미체의 좌·우 광학이성질체도 발명의 대상으로 삼으면서, 그 광학이성질체 역시 라세미체와 동일한 효과가 있음을 기재하고 있는바, 의약의 용도발명에 있어서 약리 데이터를 요구하는 것은, 약리기전이 밝혀져 있지 않은 물질의 경우 실험 데이터가 없으면 화학구조식만으로는 과연 발명이 목적으로 하는 작용효과가 일어나는 것인지를 확인할 수 없기 때문인데, 라세미체는 우선성 광학이성질체와 좌선성 광학이성질체가 화학적 결합 없이 같은 양의 혼합물이라는 점에 비추어 볼 때, 양 광학이성질체 중 어느 하나만이 약리활성을 가진다 하더라도, 라세미체의 1/2 역시 동일한 약리활성을 가지므로, 라세미체의 약리효과에 대한 실험자료는 그대로 광학이성질체의 약리효과를 입증하는 자료로 볼 수 있으며, 나머지 광학이성질체의 작용 등으로 실제 1/2의 효과가 나타나지 않을 수도 있으나 이는 어디까지나 양적인 차이에 불과하여 의약 용도발명에 있어서 약리 데이터를 요구하는 필요를 충족시키는 데에는 아무런 지장이 없다. 따라서 비교대상발명 1의 명세서를 접하는 통상의 기술자로서는, 비교대상발명 1의 위와 같은 기재를 통하여, 클로피도그렐 및 클로피도그렐 염산염도 화학식(Ⅰ) 라세미체 및 그 염산염과 마찬가지로 혈소판 응집저해 작용 및 항혈전 작용을 가지며, 저독성이어서 혈소판 질환의 치료용도로 적합할 것이라는 점을 충분히 예측할 수 있으므로(실제 이 사건 특허발명이 목적으로 하는 클로피도그렐의 약리효과, 저독성효과 및 의약용도는 양적인 차이를 별론으로 하고, 비교대상발명 1과 동일하다), 비교대상발명 1에는 클로피도그렐 염산염의 혈소판 응집저해 작용 및 항혈전 작용으로 인한 의약용도가 구체적으로 개시되어 있다고 보아야 한다.
따라서 원고의 위 주장은 이유 없다.
(다) 정 리
이 사건 제10항 발명은 비교대상발명 1에 용도발명의 대상물질 및 용도가 모두 개시되어 있으므로, 그 신규성을 인정할 수 없다.
나. 이 사건 제11항 발명에 관한 판단
이 사건 제11항 발명은 제10항 발명의 종속항으로서, 제10발명의 구성 중 단위 투여량을 0.001∼0.100g으로 한정한 것이다.
그런데 비교대상발명 1에는 화학식(Ⅰ) 라세미체의 투여량을 0.005∼0.25g으로 개시하고 있어 그 수치범위가 중복될 뿐만 아니라, 위와 같은 수치한정으로 인한 임계적 의의를 인정할 수 있는 아무런 기재가 없으므로, 진보성을 인정할 수 없다.
12. 이 사건 심결의 적법 여부 정리
가. 원고와 피고 종근당 사이
갑가 제3호증의 1의 기재에 변론 전체의 취지를 더하여 보면, 피고 종근당은 특허심판원에 2006당207호 로 이 사건 특허발명에 대한 등록무효심판을 제기하면서, 청구항 1, 6 내지 11항의 무효만 청구하고, 청구항 2 내지 5항에 대하여는 등록무효심판을 청구하지 아니하였음에도, 이 사건 심결은 이 사건 특허발명의 모든 청구항을 무효로 하는 이 사건 심결을 하였으므로, 이 사건 심결 중 이 사건 특허발명의 청구항 2 내지 5항에 관한 부분은 피고 종근당이 심판청구하지 아니한 발명에 대한 것이어서 부적법하다.
나. 원고와 나머지 피고들 사이
이 사건 제1항, 제2항, 제10항 각 발명은 비교대상발명 1에 의하여 신규성을 인정할 수 없고, 제3 내지 5항, 제11항 각 발명은 비교대상발명 1에 의하여 진보성을 인정할 수 없으며, 제6 내지 9항 각 발명은 비교대상발명 2, 3에 의하여 진보성을 인정할 수 없으므로, 이와 결론을 같이하여 이 사건 특허발명 중 청구항 1, 6 내지 11항에 대한 피고 종근당의 심판청구 및 나머지 피고들의 심판청구를 인용한 이 사건 심결은 적법하다.
13. 결 론
그렇다면 원고의 피고 엘지생명과학에 대한 소는 부적법하여 각하하고, 원고의 피고 종근당에 대한 청구 중 이 사건 특허발명의 청구항 2 내지 5에 대한 부분은 이유 있어 인용하며, 같은 피고에 대한 나머지 청구 및 나머지 피고들에 대한 청구는 모두 이유 없어 기각한다.