판시사항
명칭이 “N-치환된 2-시아노피롤리딘”인 특허발명의 특허권자인 갑 외국회사가 을 주식회사와 특허발명에 대한 통상실시권 설정계약을 체결하였고, 을 회사가 특허발명을 실시하기 위한 의약품에 대하여 수입품목허가를 받은 후 ‘특허권 설정등록일부터 수입품목허가일까지의 기간 중 심사 보완자료 준비기간을 제외한 기간’에 대하여 특허권 존속기간의 연장등록출원을 하여 등록이 이루어졌는데, 병 주식회사 등이 갑 회사를 상대로 구 특허법 제134조 제1항 제3호 에 따라 연장등록 무효심판을 청구하였고, 특허심판원이 ‘임상시험 종료 다음 날부터 원료의약품 신고서 제출일 전날까지의 기간’과 ‘원료의약품 신고필증 교부일 다음 날부터 수입품목허가 신청 및 안전성ㆍ유효성 심사의뢰서 제출일 전날까지의 기간’은 특허권자의 책임 있는 사유로 인해 소요된 기간에 해당한다고 보아 병 회사 등의 심판청구를 인용하는 심결을 한 사안에서, ‘임상시험 종료 다음 날부터 원료의약품 신고서 제출일 전날까지의 기간’은 특허권자인 갑 회사에 책임 있는 사유로 인하여 소요된 기간이라고 볼 수 없어 이 부분 심결의 판단은 위법하고, 갑 회사가 제기한 심결취소소송에서 위 기간에 대한 취소를 구하는 부분이 이유 있어 이를 인용하는 이상, 이는 연장등록된 기간 전체에 영향을 미치게 되므로 심결이 전부 취소되어야 한다고 한 사례
판결요지
명칭이 “N-치환된 2-시아노피롤리딘”인 특허발명의 특허권자인 갑 외국회사가 을 주식회사와 특허발명에 대한 통상실시권 설정계약을 체결하였고, 을 회사가 특허발명을 실시하기 위한 의약품에 대하여 수입품목허가를 받은 후 ‘특허권 설정등록일부터 수입품목허가일까지의 기간 중 심사 보완자료 준비기간을 제외한 기간’에 대하여 특허권 존속기간의 연장등록출원을 하여 등록이 이루어졌는데, 병 주식회사 등이 갑 회사를 상대로 구 특허법(2011. 12. 2. 법률 제11117호로 개정되기 전의 것, 이하 같다) 제134조 제1항 제3호 에 따라 연장등록 무효심판을 청구하였고, 특허심판원이 ‘임상시험 종료 다음 날부터 원료의약품 신고서 제출일 전날까지의 기간’(이하 ‘기간 1’이라 한다)과 ‘원료의약품 신고필증 교부일 다음 날부터 수입품목허가 신청 및 안전성ㆍ유효성 심사의뢰서 제출일 전날까지의 기간’(이하 ‘기간 2’라 한다)은 특허권자의 책임 있는 사유로 인해 소요된 기간에 해당한다고 보아 병 회사 등의 심판청구를 인용하는 심결을 한 사안이다.
기간 1의 경우, 을 회사가 사회통념상 일반적으로 요구되는 정도의 주의의무를 게을리하여 원료의약품 신고서가 늦게 제출되었다고 볼 수 없고, 기간 1 이전에 신고서를 제출했더라도 신고서 제출시기와 허가 지연 사이에 상당인과관계를 인정하기 어려울 뿐만 아니라, 구 특허법 제89조 의 ‘허가 등을 위하여 필요한 활성ㆍ안전성 등의 시험’에는 외국 임상시험도 포함되는데, 기간 1 동안에 시행된 외국 임상시험은 품목허가를 받기 위하여 필요한 자료라고 보이므로, 기간 1은 특허권자인 갑 회사에 책임 있는 사유로 인하여 소요된 기간이라고 볼 수 없어 이 부분 심결의 판단은 위법하고, 기간 2의 경우, 안전성ㆍ유효성 심사 및 품목허가를 위하여 제출의무가 있는 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매허가서’가 구비될 때까지 만연히 지체된 기간으로, 이는 특허권자인 갑 회사에 책임 있는 사유로 인하여 소요된 기간이고, 이러한 귀책사유와 허가 등의 지연 사이에 상당인과관계가 인정되므로, 이 부분 심결의 판단은 적법한데, 갑 회사가 제기한 심결취소소송에서 기간 2에 대한 취소를 구하는 부분은 이유 없으나, 기간 1에 대한 취소를 구하는 부분은 이유 있어 이를 인용하는 이상, 이는 연장등록된 기간 전체에 영향을 미치게 되므로 모두 함께 취소하여 특허심판원으로 하여금 구 특허법 제134조 제3항 에 따라 특허발명을 실시할 수 없었던 기간을 초과하여 연장된 기간에 대하여만 연장등록을 무효로 하는 심결을 하도록 하는 것이 타당하므로, 심결이 전부 취소되어야 한다고 한 사례이다.
참조조문
구 특허법(2011. 12. 2. 법률 제11117호로 개정되기 전의 것) 제89조 ( 현행 제89조 제1항 참조), 제91조 제1항 제3호 ( 현행 제91조 제3호 참조), 제2항 ( 현행 제89조 제2항 참조), 제134조 제1항 제3호 , 제3항 ( 현행 제134조 제4항 참조), 구 약사법(2007. 4. 11. 법률 제8365호로 전부 개정되기 전의 것) 제26조 제6항 ( 현행 제31조 제10항 참조), 제34조 제1항 ( 현행 제42조 제1항 참조), 제4항 ( 현행 제42조 제5항 참조), 구 약사법 시행규칙(2008. 1. 15. 보건복지부령 제434호로 전부 개정되기 전의 것) 제23조 제1항 ( 현행 의약품 등의 안전에 관한 규칙 제4조 제1항 참조), 제27조 제1항 ( 현행 의약품 등의 안전에 관한 규칙 제9조 제1항 참조)
원고
노파르티스 아게(Novartis AG) (소송대리인 변호사 김종석 외 5인)
피고
안국약품 주식회사 외 1인 (소송대리인 법무법인 규원 담당변호사 우종식 외 5인)
2020. 9. 15.
주문
1. 특허심판원이 2019. 2. 28. 2017당2256, 2017당2257호 사건에 관하여 한 심결을 취소한다.
2. 소송비용 중 30%는 원고가, 나머지는 피고들이 각 부담한다.
주문 제1항과 같다.
이유
1. 기초 사실
가. 특허권 존속기간의 연장등록 대상인 특허발명(이하 ‘이 사건 특허발명’이라 한다)
1) 발명의 명칭: N-치환된 2-시아노피롤리딘
2) 국제출원일/우선권 주장일/등록일/등록번호: 1999. 12. 9./1998. 12. 10./2005. 8. 11./(등록번호 생략)
나. 특허권 존속기간의 연장등록(이하 ‘이 사건 연장등록’이라 한다)
1) 절차의 경위
가) 연장등록출원(이하 ‘이 사건 연장등록출원’이라 한다)일/출원번호: 2008. 3. 26./(출원번호 생략)
나) 연장등록출원인: 원고
다) 출원한 연장기간: 2년 2월 23일
라) 연장등록결정: 2008. 7. 14.
2) 연장등록의 내용
가) 연장 대상 특허청구범위: 제2항, 제4항, 제7항 및 제8항
나) 연장등록 이전 존속기간 만료일: 2019. 12. 9.
다) 연장기간: 2년 2월 23일
라) 허가 또는 등록의 내용: 의약품 수입품목허가 제165호
다. 의약품 수입품목허가(이하 ‘이 사건 허가’라 한다)
1) 이 사건 허가의 경위
가) 이 사건 특허발명의 권리자인 원고는 한국노바티스 주식회사(이하 ‘한국노바티스’ 또는 ‘허가신청인’, ‘허가권자’라 한다)와 사이에 이 사건 특허발명에 대한 통상실시권 설정계약을 체결하였고, 한국노바티스는 2008. 2. 26. 위 통상실시권을 등록하였다.
| 일자 | 임상시험/특허권 설정등록/의약품 품목허가 | |||
| 2005. 1. 15. | 임상시험계획 승인 | |||
| 2005. 1. 25. | 임상시험 시작 | |||
| 2005. 8. 11. | 특허권 설정등록 | |||
| 2006. 1. 6. | 임상시험 종료 | |||
| 기간 1(132일) | ||||
| 의약품 품목허가 | ||||
| 원료의약품 정보(DMF) 심사 | 기ㆍ시 심사 | 안ㆍ유 심사 | 수입품목허가 | |
| 2006. 5. 19. | 신고서 제출 | |||
| 2006. 6. 28. | 심사의뢰서 제출 | |||
| 2006. 10. 30. | 보완(87일) | |||
| 2006. 11. 17. | 보완(52일) | |||
| 2007. 1. 9. | ||||
| 2007. 1. 26. | 심사결과 승인 | |||
| 2007. 6. 14. | 신고필증 교부 | |||
| 기간 2(55일) | ||||
| 2007. 8. 9. | 심사의뢰서 제출 | 신청서 제출 | ||
| 2007. 8. 16. | 보완(100일) | |||
| 2007. 10. 29. | 보완(2일) | |||
| 2007. 11. 1. | ||||
| 2007. 11. 26. | ||||
| 2007. 12. 28. | 수입품목허가증 교부 | |||
다) 한국노바티스는 이 사건 특허발명에 대하여, 특허권 설정등록일인 2005. 8. 11.부터 식품의약품안전청장으로부터 수입품목허가를 받은 2007. 12. 28.까지의 2년 4월 18일에서 기ㆍ시 심사의뢰에 대한 자료보완 요청일 다음 날인 2006. 11. 18.부터 보완자료 제출일 전날인 2007. 1. 8.까지 52일과 안ㆍ유 심사의뢰에 대한 식품의약품안전청의 자료보완 요청일 다음 날인 2007. 10. 30.부터 보완자료 제출일 전날인 2007. 10. 31.까지 2일을 제외한 기간인 2년 2월 23일에 대한 연장등록출원을 하였고, 그에 따라 이 사건 연장등록이 이루어졌다.
2) 이 사건 허가의 내용 등
가) 수입품목허가증 교부일: 2007. 12. 28.
나) 허가의 내용: 약사법 제42조 제1항 의 규정에 의한 의약품 수입품목허가
다) 허가의 대상이 된 물건: (의약품명 1 생략)(빌다글립틴)
라) 허가의 대상이 된 물건의 용도: 인슐린 비의존성 당뇨병 환자(제2형)에서 식사요법 및 운동요법을 시행하면서 메트포르민 또는 설포닐우레아 또는 치아졸리딘디온의 단독요법으로 충분한 혈당조절을 할 수 없는 경우 병용투여
라. 관련 규정
| 제89조(특허권의 존속기간의 연장) |
| 특허발명을 실시하기 위하여 다른 법령의 규정에 의하여 허가를 받거나 등록 등을 하여야 하고, 그 허가 또는 등록 등(이하 “허가 등”이라 한다)을 위하여 필요한 활성ㆍ안전성 등의 시험으로 인하여 장기간이 소요되는 대통령령이 정하는 발명인 경우에는 제88조 제1항의 규정에 불구하고 그 실시할 수 없었던 기간에 대하여 5년의 기간 내에서 당해 특허권의 존속기간을 연장할 수 있다. |
| 제91조(특허권의 존속기간의 연장등록거절결정) |
| ① 심사관은 특허권의 존속기간의 연장등록출원이 다음 각호의 1에 해당하는 경우에는 그 출원에 대하여 연장등록거절결정을 하여야 한다. |
| 1. 그 특허발명의 실시가 제89조의 규정에 의한 허가 등을 받을 필요가 있는 것으로 인정되지 아니하는 경우 |
| 2. 그 특허권자 또는 그 특허권의 전용실시권이나 등록된 통상실시권을 가진 자가 제89조의 규정에 의한 허가 등을 받지 아니한 경우 |
| 3. 연장신청의 기간이 그 특허발명을 실시할 수 없었던 기간을 초과하는 경우 |
| 4. 연장등록출원인이 당해 특허권자가 아닌 경우 |
| 5. 제90조 제3항의 규정에 위반하여 연장등록출원을 한 경우 |
| 6. 삭제 〈1998. 9. 23.〉 |
| ② 특허권자에게 책임 있는 사유로 인하여 소요된 기간은 제1항 제3호의 “그 특허발명을 실시할 수 없었던 기간”에 포함되지 아니한다. |
2) 관련 고시
이 사건 연장등록출원의 출원(2008. 3. 26.) 당시 시행 중이었던 ‘특허권의 존속기간의 연장제도 운용에 관한 규정’(이하 ‘특허청 고시’라 한다) 제2005-13호(2005. 6. 17. 시행)의 부칙 제2조(경과조치)에는 “이 고시 시행일 이전에 이미 품목허가를 받았거나 등록을 한 의약품ㆍ농약 또는 농약원제와 품목허가ㆍ등록 신청 중인 의약품ㆍ농약 또는 농약원제의 연장등록출원에 대하여는 종전의 규정에 따른다.”라고 기재되어 있다. 위 부칙 제2조에서 규정하고 있는 ‘품목허가 신청’에는 품목허가를 위한 사전절차로서 ‘임상시험계획 승인신청’도 포함된다고 할 것이고, 이 사건 허가를 위한 임상시험계획 승인일은 위 고시 시행일인 2005. 6. 17. 이전인 2005. 1. 15.이므로, 위 경과조치에 의해 이 사건 연장등록출원에는 특허청 고시 제2000-7호가 적용된다( 특허법원 2018. 1. 26. 선고 2016허83 판결 참조). 이 점에 대해서는 당사자 사이에 다툼이 없다.
| [특허청 고시 제2000-7호(2000. 12. 20. 시행, 이하 ‘2000년 특허청 고시’라 한다)] |
| 제4조(연장받을 수 있는 기간) |
| 특허법 제89조의 규정에 의하여 특허발명을 실시할 수 없었던 기간은 다음 각호에 해당하는 기간을 말한다. |
| 1. 약사법 제26조 제6항의 규정에 의한 임상시험용 의약품으로서 동법 시행규칙 제29조의 규정에 의하여 식품의약품안전청장으로부터 임상시험계획서의 승인을 받은 날 또는 특허권의 설정등록일 중 늦은 날부터 약사법 제26조 제1항 또는 동법 제34조 제1항의 규정에 의한 의약품 허가를 받은 날까지의 기간. 다만 외국에서 개발된 신약으로서, 식품의약품안전청장이 정한 의약품임상시험관리기준(KGCP)에 따른 국내 임상시험의 실시를 관계 규정에 의거 면제받은 경우(식품의약품안전청장이 정한 의약품 등의 안전성ㆍ유효성 심사에 관한 규정에 의해 가교자료의 제출을 하지 않는 경우는 제외)에는 의약품 등의 안전성ㆍ유효성 심사에 관한 규정에 적합한 국내 제3상 임상시험에 상응하는 외국에서의 제3상 임상시험 소요 기간을 당해 의약품의 개발국 정부(허가 또는 등록 기관)가 임상시험 성적자료로서 제출받았거나 승인하였음을 확인한 자료나 이를 공증한 자료로부터 산정하고, 이 기간에 식품의약품안전청에 약사법 제26조 제1항 또는 동법 제34조 제1항의 규정에 의한 의약품 허가를 받기 위하여 관련 서류를 접수한 날부터 의약품 제조 허가를 받은 날까지의 기간을 합산한 기간을 연장 대상 기간으로 한다. |
| [특허청 고시 제2005-13호(2005. 6. 17. 시행)] |
| 제4조(연장기간의 산정) |
| 특허법 제89조 규정의 “그 실시할 수 없었던 기간”이라 함은 특허권 설정등록일 이후의 기간으로서 다음 각호의 1에 해당하는 기간을 말한다. 다만 해당 관청의 허가 또는 등록 신청 관련 서류의 검토기간 중 특허권자 또는 신청인의 책임 있는 사유로 인하여 소요된 기간은 “그 실시할 수 없었던 기간”에 포함하지 아니한다. |
| 1. 의약품(동물용 의약품은 제외한다)의 품목허가를 받기 위하여 식품의약품안전청장의 승인을 얻어 실시한 임상시험기간과 식품의약품안전청에서 소요된 허가신청 관련 서류의 검토기간을 합산한 기간 |
| [부칙] |
| 제1조(시행일) 이 고시는 고시한 날부터 시행한다. |
| 제2조(경과조치) 이 고시 시행일 이전에 이미 품목허가를 받았거나 등록을 한 의약품ㆍ농약 또는 농약원제와 품목허가ㆍ등록 신청 중인 의약품ㆍ농약 또는 농약원제의 연장등록출원에 대하여는 종전의 규정에 따른다. |
마. 이 사건 심결의 경위
1) 피고 1은 특허심판원 2017당2256호로, 피고 2는 특허심판원 2017당2257호로 각각 이 사건 특허발명의 특허권자인 원고를 상대로 “이 사건 특허발명에 대한 존속기간이 연장된 2년 2월 23일 중 187일은 연장기간에 포함되어서는 안 되는 기간이므로, 그 기간은 구 특허법 제134조 제1항 제3호 의 규정에 의해 무효로 되어야 한다.”라고 주장하면서 이 사건 연장등록에 대한 무효심판을 청구하였다(이하 ‘이 사건 각 심판청구’라 한다).
2) 특허심판원은 이 사건 각 심판청구를 병합하여 심리한 다음, 2019. 2. 28. 다음과 같은 이유로 “① 임상시험 종료 다음 날인 2006. 1. 7.부터 원료의약품 신고서 제출일 전날인 2006. 5. 18.까지의 132일에 해당하는 기간(이하 ‘기간 1’이라 한다)과 ② 원료의약품 신고필증 교부일 다음 날인 2007. 6. 15.부터 수입품목허가 신청 및 안ㆍ유 심사의뢰서 제출일 전날인 2007. 8. 8.까지의 55일에 해당하는 기간(이하 ‘기간 2’라 한다)은 특허권자의 책임 있는 사유로 인해 소요된 기간에 해당하므로 이 사건 특허발명에 대한 존속기간이 연장된 2년 2월 23일의 기간 중 기간 1, 2에 해당하는 187일은 무효를 면할 수 없다.”라고 판단하여 피고들의 이 사건 각 심판청구를 인용하는 이 사건 심결을 하였다.
가) 기간 1은 다음과 같은 이유로 특허권자의 책임 있는 사유로 인해 소요된 기간에 해당한다.
① 원료의약품 신고나 기ㆍ시 심사의뢰 시 필요한 자료는 임상시험에서 얻어지는 의약품의 유효성과 안전성에 관한 자료와는 관련이 없는 것이므로, 임상시험 자료의 분석과 정리를 위해 원료의약품 신고나 기ㆍ시 심사의뢰가 기간 1만큼 지연되어야 할 상당한 이유는 없다.
② 기간 1에 제출된 임상연구보고서, 민족적 감수성 보고서, 하위군 분석보고서, (의약품명 1 생략) 가교자료, 식품의약품안전청 설명회 자료는 임상시험에 관한 자료로 안ㆍ유 심사를 위하여 제출해야 하는 자료이기는 하지만, 원료의약품 신고나 기ㆍ시 심사에 필요한 자료는 아니다.
③ 원료의약품에 대한 자료는 특허권자인 원고가 한국에서 임상시험을 실시하기 전에 이미 확보하고 있었다고 봄이 상당하고, 또한 임상시험 종료 후 기간 1(132일)이 도과할 때까지 특허권자가 어떠한 사유로 인하여 원료의약품 신고를 지체하였는지도 알기 어려우며, 나아가 기간 1이 의약품 수입품목허가 절차 중 하나인 원료의약품 신고에 반드시 소요되는 정도의 준비기간이라고 볼 만한 사정도 나타나지 않는다.
나) 기간 2도 다음과 같은 이유로 특허권자의 책임 있는 사유로 인해 소요된 기간에 해당한다.
① 식품의약품안전청 내의 의약품 허가에 관한 심사부서는 각 담당부서별로 업무가 분장되어 있고, 제출된 자료에 대한 심사는 독립적으로 진행되므로, 원료의약품 심사 절차가 진행 중일 때 안ㆍ유 심사를 의뢰할 수 있다고 봄이 상당하다. 그런데 원료의약품 신고필증을 교부받고 나서도 아무런 후속 절차도 진행하지 않고 55일의 기간 2가 지난 2007. 8. 9.에서야 비로소 안ㆍ유 심사를 의뢰한 사실에 비추어 보면, 위 기간 2는 특허권자의 상업적 고려나 업무 미숙 등의 개인적 사정으로 인해 지연된 귀책기간에 해당한다.
② 이 사건 품목허가를 위해 한국 내에서 시행한 임상시험은 한국인을 대상으로 안전성과 유효성을 확증하는 정도의 가교 시험, 즉 간단한 통계적 처리를 통하여 정리가 가능한 수준의 임상시험을 수행한 것이므로, 2006. 1. 6. 임상시험 종료 후 2007. 8. 9.에서야 비로소 안ㆍ유 심사의뢰가 이루어지기까지 약 1년 7개월의 지연된 기간은 특허권자에게 귀책사유가 있다고 보는 것이 타당하다.
③ 허가신청인이 허가신청을 자진하여 취하한 이상 특허권자에게 귀책사유가 있어서 자진하여 취하한 것이라고 보는 게 합리적이다.
[인정 근거] 다툼 없는 사실, 갑 제1 내지 5, 7, 8, 12, 14, 16, 23, 26 내지 28, 40, 41호증의 각 기재, 변론 전체의 취지
2. 당사자 주장의 요지
가. 원고
1) 이 사건 심결에서 귀책기간으로 판단한 기간 1, 2는 특허청의 내부 사무처리준칙으로서 행정규칙인 ‘2000년 특허청 고시’에 따라 특허청 자신이 반복된 행정으로서 연장을 인정해 왔던 기간일 뿐 아니라, 특허법원 2018. 1. 26. 선고 2016허83 판결 에서도 당시의 고시에 따른 ‘기대이익’으로 해당 기간을 포함하고 있음에도, 이 사건 심결은 이와 달리 판단함으로써 재량권을 일탈ㆍ남용하였고 원고의 기대이익을 침해하였다.
2) 기간 1은 다음과 같은 이유로 특허권자인 원고에게 책임 있는 사유로 인하여 소요된 기간이라고 볼 수 없으므로 이와 달리 판단한 이 사건 심결은 위법하다.
① 이 사건 심결은 (의약품명 1 생략)의 허가를 위하여 검토된 51개의 임상들 중 1개에 불과한 국내 임상시험의 종료에 의하여 (의약품명 1 생략)의 임상 단계가 종료된 것으로 잘못 파악하여, 기간 1에는 2384 외국 임상시험이 진행 중에 있었음에도 임상시험이 종료되었다고 보고, 그로부터 허가 절차 개시 사이의 기간 1을 귀책기간으로 잘못 판단하였다. 2384 외국 임상시험은 이 사건 허가를 위해서 필요한 시험이고, 그 임상기간을 존속기간 연장기간에서 제외할 법적 근거는 없다.
② 임상시험과 품목허가 심사는 DMF 심사와 하등의 상관관계가 없고, 관련 법규에도 국내 임상시험 종료 이전에 DMF 신고서를 제출하여야 한다거나 DMF 신고 절차 종료 이전에 품목허가를 신청해야 한다는 주의의무를 허가권자에게 부여하고 있지 않다.
③ ‘DMF 절차’와 ‘안ㆍ유 절차’는 서로 독립된 절차이므로 기간 1 이전에 DMF 신고서를 제출한다고 하더라도 허가가 빨라지지 않는다. 또한 이 사건 품목허가를 위해서는 제조ㆍ판매증명서를 제출하여야 하는데, 이는 유럽 품목허가일인 2007. 9. 25. 이후에나 가능하였으므로, 기간 1 이전에 DMF 신고서를 제출하였다고 하더라도 허가일이 앞당겨지지 않았을 것이다. 따라서 DMF 신고서 제출시기와 허가 지연 사이에 상당인과관계가 없다.
④ 허가권자는 기간 1 동안 2355 국내 임상시험에 대한 보고서 및 아시아인 환자들에 대한 민족적 감수성 보고서, 한국인 환자들에 대한 연구보고서(갑 제8, 10, 11호증)를 작성하여 식품의약품안전청에 제출하였고, 이는 이 사건 허가를 위해 소요된 기간으로 구 특허법 규정에 따라 연장기간에 포함되어야 한다.
3) 기간 2는 다음과 같은 이유로 특허권자인 원고에게 책임 있는 사유로 인하여 소요된 기간이라고 볼 수 없으므로 이와 달리 판단한 이 사건 심결은 위법하다.
① 기간 2 중 이 사건 품목허가 신청이 취하된 바 있으나, 기간 2 시작일인 2007. 6. 15.부터 2차 안ㆍ유 심사의뢰서 취하일인 2007. 7. 31.까지의 기간(이하 ‘기간 2-①’이라 한다)인 47일 동안 식품의약품안전청에서 2차 안ㆍ유 심사를 진행 중이었으므로 허가를 위하여 소요된 기간이고, 더욱이 절차가 취하되어도 이미 행하여진 식품의약품안전청의 검토는 없었던 사실로 되지 않고 재신청 시에는 이미 검토를 받았던 내용은 검토가 생략되거나 신속하게 마무리되는 것이 현실이므로, 취하 사실만으로 귀책사유라고 볼 수 없다.
② 이 사건 품목허가를 받기 위하여서는 관련 규정에 따라 식품의약품안전청에 제조ㆍ판매증명서를 제출하여야 하고, 이 사건 품목허가 신청 당시 제출된 자료가 유럽 자료이므로 유럽 제조ㆍ판매증명서를 제출하여야 하는데, 이는 유럽 품목허가를 받은 2007. 9. 25. 이후에나 제출 가능한 것이므로, 이 사건 품목허가 신청 당시에는 제출할 수 없었던 서류로서 허가권자의 ‘책임영역을 벗어난 사정’이다. 그렇다면 기간 2 중 2차 안ㆍ유 심사의뢰서 취하일 다음 날인 2007. 8. 1.부터 3차 안ㆍ유 심사의뢰서 제출일 전날인 2007. 8. 8.까지 기간(이하 ‘기간 2-②’라 한다)이 없었다고 하여 유럽 허가가 빨라지지는 않았을 것이므로, 이 사건 품목허가 지연과의 상당인과관계를 인정하기 어렵다. 또한 기간 2-② 동안 허가권자는 추가 임상시험자료와 식품의약품안전청 보완자료를 준비 중이었으므로 이 사건 허가를 위해 필요한 기간이었다.
③ 기간 2에 대해서도 이 사건 심결은 DMF와 품목허가(안ㆍ유 심사) 신청은 서로 무관하므로 DMF 절차 중에 품목허가(안ㆍ유 심사) 신청을 할 수 있었다는 가상의 이상적 시나리오로 대체하여 허가의 지연 기간을 설정한 잘못이 있다.
나. 피고들
1) 구 특허법 제89조 는 그 문언 자체로 ‘특허발명을 실시할 수 없었던 기간 중, ① 허가를 받거나 등록 등을 하는 데 직접 소요된 기간 및 ② 그 허가 또는 등록 등을 위하여 필요한 활성ㆍ안전성 등의 시험으로 인하여 장기간이 소요되는 기간’을 보호하려는 데에 그 목적이 있다. 따라서 기간 1, 2는 원고가 ‘상업적 고려’나 ‘업무 미숙’ 등으로 특허발명의 실시를 위한 허가나 등록을 신청하지 아니하여 식품의약품안전청의 어떠한 심사도 없었던 기간으로서 원고의 책임 있는 사유로 인하여 소요된 기간이다. 또한 허가신청인의 이 사건 품목허가가 늦어진 이유는 허가에 필요한 자료인 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매증명서’를 구비하지 못했기 때문이고 이러한 심사를 받기 위한 자료가 없다면 당연히 심사를 신청한 자의 귀책사유에 불과하다.
2) 기간 1은 다음과 같은 이유로 특허권자인 원고에게 책임 있는 사유로 인하여 소요된 기간이다.
① 임상시험 자료의 분석과 정리를 위하여 원료의약품 신고나 기ㆍ시 심사의뢰가 지연되어야 할 상당한 이유가 존재하지 않고, 그 원료의약품에 대한 자료는 허가권자가 한국에서 임상시험을 실시하기 전 이미 확보하고 있었다고 봄이 상당하며, 기간 1이 원료의약품 신고에 반드시 소요되는 정도의 준비기간이라는 사정도 존재하지 않는다.
② 허가권자가 존속기간 연장등록처분 당시 제출하거나 주장하지 않았던 ‘국내 임상시험 종료 후에도 2006. 7. 14.까지 외국 임상시험이 진행되었다는 사실’ 등을 새롭게 내세우며 이 사건 특허권 존속기간 연장등록의 유효를 주장하는 것은 위법한 주장으로서 허용될 수 없다.
③ 빌다글립틴의 위약대조 단독요법 시험은 2301과 2384의 2가지 시험이 존재하였고, 2301 시험만으로도 국내절차상 이 사건 특허를 실시하는 것에는 어떠한 법률적 장애도 없었으며, 차후에 2384 시험을 제출하였다고 할지라도 이 시험이 필수적이었다고 할 수는 없다.
3) 기간 2는 다음과 같은 이유로 특허권자인 원고에게 책임 있는 사유로 인하여 소요된 기간이다.
① 원료의약품 신고 결과나 기ㆍ시 심사결과가 안ㆍ유 심사에 제출되어야 하는 자료와 직접적인 관련성이 없고, 원료의약품 심사 절차가 진행 중일 때 안ㆍ유 심사를 의뢰할 수 있다고 봄이 상당하다.
② 허가권자는 임상시험 종료 후 2007. 5. 4. 수입품목허가 신청을 하였다가 2007. 7. 31. 허가신청을 자진 취하한 사실이 있는데, 위와 같은 자진 취하 기간은 허가권자에게 귀책사유가 있어 자진하여 취하한 것으로 보는 것이 합리적이다.
③ 제조ㆍ판매증명서 제출과 관련된 지연 기간은 허가권자의 상업적인 고려에 의한 것일 뿐이므로, 연장등록의 대상이 될 수 없다. 허가권자는 국내에서 임상시험을 하여 허가받거나 수입품목허가가 아닌 제조품목허가를 받을 수도 있었고, 이 경우 신속히 제조품목허가를 받을 수 있었을 것이다.
④ 수입품목허가를 받기 위하여 법령 및 고시에서 요구하는 자료들을 제출하지 못한 것은 허가권자의 귀책사유에 해당한다. 또한 위 자료를 준비하는 기간이 존속기간을 연장하여 주어야 할 기간에 포함된다고 볼 수 없다. 나아가 특허권 존속기간 연장등록과 관련하여 외국의 허가 절차까지 고려한다면 법적 안정성을 크게 해치게 된다.
⑤ 허가권자는 이 사건 연장등록출원을 하면서 스스로 식품의약품안전청 심사 절차가 중단되었던 2006. 11. 18.부터 2007. 1. 8.까지의 기간이 특허권자에게 책임 있는 사유로 인하여 소요된 기간임을 인정하였는데, 이제 와서 종전의 태도를 바꾸어 ‘유럽 품목허가를 받기 위해 소요된 기간은 귀책기간에 해당하지 않는다.’고 주장하는 것은 금반언의 원칙에 반하여 부당하다. 그리고 이러한 주장은 실질적으로 허가권자가 특허권 존속기간 연장등록출원 당시에는 전혀 주장하지 않았던 새로운 사유에 근거한 것으로 허용되지 않는다.
4) 2007. 11. 1.부터 2007. 11. 26. 사이에 안ㆍ유 심사가 종료되어 수입품목허가부서에 통지되었다면 통지일 이후부터 2007. 11. 26.까지의 기간은 관련 부서의 어떠한 심사도 이루어지지 않은 기간이므로 무효이다.
3. 이 사건 심결의 위법 여부
가. 쟁점
1) 이 사건 연장등록출원의 심사과정에서는 이 사건 특허발명의 허가 대상 의약품인 (의약품명 1 생략)에 대한 특허권 설정등록일인 2005. 8. 11.부터 수입품목허가일인 2007. 12. 28.까지의 기간 중 기ㆍ시 심사에 대한 보완자료 요청일 다음 날인 2006. 11. 18.부터 보완자료 제출일 전날인 2007. 1. 8.까지의 기간(52일) 및 안ㆍ유 심사 보완자료 요청일 다음 날인 2007. 10. 30.부터 보완자료 제출일 전날인 2007. 10. 31.까지의 기간(2일) 등 모두 54일(아래 [표]에서 파란색 부분)을 제외한, 2005. 8. 11.부터 2006. 11. 17.까지의 기간(1년 3월 6일), 2007. 1. 9.부터 2007. 10. 29.까지의 기간(9월 20일) 및 2007. 11. 1.부터 2007. 12. 28.까지의 기간(1월 27일)을 모두 합산한 ‘2년 2월 23일’에 해당하는 기간이 연장등록되었다.
2) 이 사건 특허발명의 연장등록기간 2년 2월 23일 중 ① 임상시험 종료 다음 날인 2006. 1. 7.부터 원료의약품 신고서 제출일 전날인 2006. 5. 18.까지의 132일에 해당하는 기간 1과 ② 원료의약품 신고필증 교부일 다음 날인 2007. 6. 15.부터 수입품목허가 신청 및 안ㆍ유 심사의뢰서 제출일 전날인 2007. 8. 8.까지의 55일에 해당하는 기간 2(아래 [표]에서 빨간색 부분)가 허가권자 등의 책임 있는 사유로 인하여 소요된 기간, 즉 귀책기간에 해당하는지 여부가 쟁점이다.
| 일자 | 내용 | |||
| 2005. 1. 25. | 국내 임상시험(CLAF237A2355) 개시(갑 제8호증) | |||
| 2005. 6. 29. | 외국 임상시험(CLAF237A2384) 개시(갑 제9호증) | |||
| 2005. 8. 11. | 특허권(특허 제509311호) 설정등록(갑 제1, 2호증) | |||
| 2006. 1. 6. | 국내 임상시험(CLAF237A2355) 종료(갑 제8호증) | |||
| 기간 1(132일: 2006. 1. 7.~2006. 5. 18.) | ||||
| Drug Product Approval | ||||
| DMF 심사 | 기ㆍ시 심사 | 안ㆍ유 심사 | 허가 | |
| 2006. 5. 19. | DMF 신고(갑 제12호증) | |||
| 2006. 6. 2. | 1차 심사의뢰(갑 제13호증) | |||
| 2006. 6. 28. | 심사의뢰(갑 제14호증) | |||
| 2006. 7. 14. | 외국 임상시험(CLAF237A2384) 종료(갑 제9호증) | |||
| 2006. 10. 30. | 보완요청(갑 제12호증) | |||
| 2006. 11. 17. | 보완요청(갑 제14호증) | |||
| 2007. 1. 9. | 보완자료 제출(갑 제14호증) | |||
| 2007. 1. 26. | 보완자료 제출(갑 제12호증) | 심사결과 승인(갑 제16호증) | ||
| 2007. 2. 2. | 보완요청(갑 제17호증) | |||
| 2007. 3. 30. | 1차 안ㆍ유 취하(갑 제19호증) | |||
| 2007. 5. 4. | 2차 안ㆍ유 및 1차 품목허가 신청(갑 제20호증) | |||
| 2007. 5. 29. | 보완요청(갑 제21호증) | |||
| 2007. 5. 31. | 보완자료 CD 제출(갑 제22호증) | |||
| 2007. 6. 14. | 신고필증(갑 제23호증) | |||
| 기간 2(55일: 2007. 6. 15.~2007. 8. 8.) | ||||
| 2007. 7. 30. | 보완독촉(갑 제24호증) | |||
| 2007. 7. 31. | 2차 안ㆍ유 및 1차 품목허가 신청 취하(갑 제25호증) | |||
| 2007. 8. 9. | 3차 안ㆍ유 및 2차 품목허가 신청(갑 제26호증) | |||
| 2007. 8. 16. | 보완요청(갑 제27호증) | |||
| 2007. 10. 29. | 보완요청(갑 28호증) | |||
| 2007. 11. 1. | 보완자료 제출(갑 제28호증) | |||
| 2007. 11. 26. | 보완자료 제출(갑 제27호증) | |||
| 2007. 12. 28. | 허가증(갑 제41호증) | |||
나. 주5) 관련 법리
1) 의약품 등의 발명을 실시하기 위해서는 국민의 보건위생을 증진하고 안전성 및 유효성을 확보하기 위해 약사법 등에 따라 허가 등을 받아야 하는데, 특허권자는 이러한 허가 등을 받는 과정에서 그 특허발명을 실시하지 못하는 불이익을 받게 된다. 따라서 위와 같은 불이익을 구제하고 의약품 등의 발명을 보호ㆍ장려하기 위해 구 특허법(2014. 6. 11. 법률 제12753호로 개정되기 전의 것, 이하 ‘관련 법리’에서 같다) 제89조 제1항 은 “특허발명을 실시하기 위하여 다른 법령의 규정에 의하여 허가를 받거나 등록 등을 하여야 하고, 그 허가 또는 등록 등(이하 ‘허가 등’이라 한다)을 위하여 필요한 활성ㆍ안전성 등의 시험으로 인하여 장기간이 소요되는 대통령령이 정하는 발명인 경우에는 제88조 제1항 의 규정에 불구하고 그 실시할 수 없었던 기간에 대하여 5년의 기간 내에서 당해 특허권의 존속기간을 연장할 수 있다.”라고 규정하여 약사법 등에 의한 허가 등을 받기 위하여 특허발명을 실시할 수 없었던 기간만큼 특허권의 존속기간을 연장해 주는 제도를 마련하였다. 다만 구 특허법 제89조 제2항 은 “ 제1항 을 적용함에 있어서, 특허권자에게 책임 있는 사유로 소요된 기간은 제1항 의 ‘실시할 수 없었던 기간’에 포함되지 아니한다.”라고 규정하고 있으므로, 허가 등을 받은 자의 귀책사유로 약사법 등에 따라 허가 등의 절차가 지연된 경우에는 그러한 귀책사유가 인정되는 기간은 특허권 존속기간 연장의 범위에 포함되어서는 안 된다. 한편 특허권 존속기간의 연장등록을 받는 데에 필요한 허가 등을 신청할 수 있는 자의 범위에는 특허권자 외에 전용실시권자 및 통상실시권자가 포함되므로, 위 규정의 ‘특허권자에게 책임 있는 사유’를 판단할 경우에도 위 허가 등을 신청한 전용실시권자와 통상실시권자에 관한 사유가 포함된다고 해석함이 타당하다. 그리고 허가 등을 받은 자의 귀책사유로 인하여 약사법 등에 따른 허가 등의 절차가 지연된 기간이 연장등록에 의하여 연장된 기간 안에 포함되어 있어 연장된 기간이 구 특허법 제89조 제1항 의 특허발명을 실시할 수 없었던 기간을 초과한다는 사유로 구 특허법 제134조 제1항 제3호 에 의하여 존속기간 연장등록에 대하여 무효심판을 청구하는 자는 그 사유에 대하여 주장ㆍ증명할 책임을 진다( 대법원 2017. 11. 29. 선고 2017후844, 851, 868, 875 판결 참조).
2) 구 특허법 제89조 제2항 은 특허권자 등에게 책임 있는 사유로 인하여 소요된 기간을 특허발명을 실시할 수 없었던 기간에서 제외하고 있는데, 여기서 ‘책임 있는 사유로 인하여 소요된 기간’이란 특허권자 등의 귀책사유로 인하여 약사법 등의 허가 등이 실제로 지연된 기간, 즉 특허권자 등의 귀책사유와 약사법 등에 의한 허가 등의 지연 사이에 상당인과관계가 인정되는 기간을 의미한다( 특허법원 2017. 3. 16. 선고 2016허4498, 4504, 4511, 5620 판결 등 참조).
다. 기간 1에 관하여
기간 1은 국내 임상시험이 종료된 다음 날인 2006. 1. 7.부터 DMF 신고서 제출일 전날인 2006. 5. 18.까지의 132일이고, 아래 [표]의 빨간색 표시 부분이다.
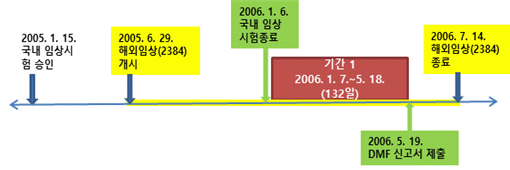
1) 귀책사유
가) 기간 1 이전(국내 임상시험 종료일 이전)에 DMF 신고서를 제출할 주의의무 여부
(1) 구 약사법(2007. 4. 11. 법률 제8365호로 전부 개정되기 전의 것, 이하 같다) 제34조 제1항 의 위임에 따라 구 약사법 시행규칙(2008. 1. 15. 보건복지부령 제434호로 전부 개정되기 전의 것, 이하 같다) 제23조 제1항 제1호 (아)목 에서는, ‘[별지 제12호 서식]에 의한 신청서’(‘품목허가신청서’를 말한다)에 ‘원료의약품 신고서(‘DMF 신고서’를 말한다) 및 첨부자료’를 첨부하여 제출하도록 규정하고 있을 뿐이고, 동법 시행령 및 시행규칙 어디에도 허가권자가 DMF 신고서를 국내 임상시험 종료일 이전에 제출해야 한다는 규정을 두고 있지 않다.
| [구 약사법] |
| 제34조(의약품 등의 수입허가 등) |
| ① 의약품 등을 수입하고자 하는 자(이하 “수입자”라 한다)는 보건복지부령이 정하는 바에 의하여 품목마다 식품의약품안전청장의 허가를 받거나 신고를 하여야 한다. 허가받은 사항 또는 신고한 사항을 변경하고자 할 때에도 또한 같다. |
| [구 약사법 시행규칙] |
| 제23조(제조ㆍ수입품목의 허가신청 등) |
| ① 법 제26조 제1항 또는 법 제34조 제1항의 규정에 의하여 의약품 등의 품목허가를 받고자 하는 자는 [별지 제12호 서식]에 의한 신청서(전자문서로 된 신청서를 포함한다)에 다음 각호의 구분에 따른 서류(전자문서를 포함한다)를 첨부하여 식품의약품안전청장에게 제출하여야 한다. |
| 1. 의약품ㆍ의약외품 (중략) |
| 가. 제27조의 규정에 의한 안전성ㆍ유효성 심사결과통지서로서 2년이 지나지 아니한 것 또는 안전성ㆍ유효성 심사에 필요한 자료. (중략) |
| 나. 제27조의2의 규정에 의한 기준 및 시험방법 심사결과통지서로서 2년이 지나지 아니한 것 또는 기준 및 시험방법에 관한 자료. |
| (중략) |
| 아. 제24조 제1항 제6호의 규정에 의한 원료의약품(이하 “신고대상 원료의약품”이라 한다)을 사용하는 품목의 경우에는 제24조 제3항의 규정에 의한 원료의약품 신고서 및 첨부자료. (후략) |
(2) 제약업계에서는 통상적으로 임상시험이 종료된 이후에 품목허가 신청과 동시에 또는 그 무렵에 DMF 신고서를 제출하는 경우가 많고[ 특허법원 2017. 3. 16. 선고 2016허4498, 4504 등 판결 에서의 ‘(의약품명 2 생략)’ 의약품, 특허법원 2018. 2. 1. 선고 2016허3549, 3563 등 판결 에서의 ‘(의약품명 3 생략)’ 의약품, 특허법원 2018. 8. 10. 선고 2016허4535 판결 에서의 ‘(의약품명 4 생략)’ 의약품, 특허법원 2018. 1. 19. 선고 2017허1557 판결 에서의 ‘(의약품명 5 생략)’ 의약품, 특허법원 2017. 12. 21. 선고 2017허639, 646 등 판결 에서의 ‘(의약품명 6 생략)’ 의약품, 특허법원 2018. 1. 12. 선고 2016허9639, 9653 판결 에서의 ‘(의약품명 7 생략)’ 의약품 등], 이러한 제약업계 실무를 볼 때, 이 사건 의약품의 경우 사회통념상 일반적으로 요구되는 정도의 주의의무를 게을리하여 DMF 신고서가 늦게 제출되었다고 보기도 어렵다.
나) DMF 신고서 제출시기와 허가 지연 사이에 상당인과관계 여부
이 사건 허가 절차에 있어서 DMF 심사와는 별개로 안ㆍ유 심사가 진행 중이었고, 원료의약품 자체의 물리화학적 특성, 공정관리 등에 관한 자료를 제출하여 심사받는 DMF 심사 절차와 허가 대상 의약품의 안전성 및 유효성을 심사하는 안ㆍ유 심사 절차는 서로 독립적인 절차이기 때문에 DMF 심사 절차를 기간 1 이전으로 앞당긴다고 하더라도 안ㆍ유 심사 절차가 앞당겨진다고 볼 수 없다. 따라서 기간 1 이전에 DMF 신고서를 제출했다 하더라도 이 사건 허가가 빨라진다고 볼 수 없으므로, DMF 신고서 제출시기와 허가 지연 사이에 상당인과관계를 인정하기 어렵다.
2) 기간 1 동안에 시행된 2384 외국 임상시험기간이 특허발명을 실시할 수 없었던 기간에 해당하는지 여부
가) 구 특허법 제89조 의 ‘허가 등을 위하여 필요한 활성ㆍ안전성 등 시험’에 외국 임상시험이 제외되는지 여부
(1) 구 특허법 제89조 는 ‘허가 등을 위하여 필요한 활성ㆍ안전성 등의 시험’이라고 규정하고 있고, 구 약사법 제34조 제4항 이 준용하는 제26조 제6항 은 허가를 받기 위해 ‘안전성ㆍ유효성에 관한 시험성적서’를 제출하도록 하고 있을 뿐, 이를 위한 임상시험이 국내에서 실시될 것을 한정하고 있지 않다.
| [구 약사법] |
| 제34조(의약품 등의 수입허가 등) |
| ① 의약품 등을 수입하고자 하는 자(이하 “수입자”라 한다)는 보건복지부령이 정하는 바에 의하여 품목마다 식품의약품안전청장의 허가를 받거나 신고를 하여야 한다. 허가받은 사항 또는 신고한 사항을 변경하고자 할 때에도 또한 같다. |
| ②, ③ 생략 |
| ④ 제26조 제6항 내지 제8항, 제26조의2, 제26조의3, 제29조 내지 제31조 및 제68조의 규정은 제1항의 규정에 의하여 수입되는 의약품 등 또는 그 수입자에 대하여 이를 준용한다. 이 경우 “제조” 또는 “생산”은 “수입”으로, “제조업자”는 “수입자”로 본다. 〈개정 2000. 1. 12.〉 |
| 제26조(제조업의 허가 등) |
| ① 의약품의 제조를 업으로 하고자 하는 자는 보건복지부령이 정하는 바에 의하여 식품의약품안전청장의 허가를 받아야 하고, 의약외품의 제조를 업으로 하고자 하는 자는 식품의약품안전청장에게 신고를 하여야 하며, 품목별로 품목허가를 받거나 품목신고를 하여야 한다. (이하 생략) |
| ② 내지 ⑤ 생략 |
| ⑥ 제1항의 경우에 허가를 받고자 하는 품목이 신약인 경우에는 안전성ㆍ유효성에 관한 시험성적서ㆍ관계 문헌 기타 필요한 자료를 보건복지부령이 정하는 바에 의하여 제출하여야 한다. |
(2) 구 약사법에 의해 위임을 받은 동법 시행규칙 제27조 제1항은 ‘안전성ㆍ유효성에 관한 시험성적서’의 하나로 ‘임상시험성적에 관한 자료’를 들고 있고 이에 관한 세부규정은 식품의약품안전청장이 정하도록 위임하고 있다.
| 제27조(안전성ㆍ유효성의 심사) |
| ① 제23조 제1항, 법 제26조 제1항ㆍ제6항 및 제8항 또는 법 제34조 제1항ㆍ제4항 및 제5항의 규정에 의하여 의약품 등의 품목허가 또는 품목변경허가를 받거나 품목신고 또는 품목변경신고를 하고자 하는 자는 다음 각호의 자료(전자문서를 포함한다)를 갖추어 그 품목에 대한 안전성ㆍ유효성의 심사를 받아야 한다. 이 경우 심사대상품목, 자료작성요령, 각 자료의 요건 및 면제범위ㆍ심사기준 등에 관한 세부규정과 독성 및 약리작용 등에 관한 자료의 작성을 위하여 실시하는 비임상시험의 관리에 필요한 사항은 식품의약품안전청장이 정하는 바에 의한다. |
| (중략) |
| 6. 임상시험성적에 관한 자료 (하략) |
(3) 구 약사법 시행규칙에 의해서 세부규정의 위임을 받은 ‘의약품 등의 안전성ㆍ유효성 심사에 관한 규정’(식품의약품안전청 고시 제2007-30호, 2007. 5. 25. 시행, 이하 ‘식품의약품안전청 고시’라 한다) 제6조 제1항 제6호 가.의 2)의 가)항은 ‘외국’에서 시험한 자료라도 ‘허가국 정부(허가 또는 등록 기관)가 제출받았거나 승인하였음을 확인한 것 또는 이를 공증한 자료’라면 적법한 허가자료로 인정하고 있다.
| 제6조(제출자료의 요건) |
| ① 제5조 제1항 내지 제9항의 규정에 의한 자료의 요건은 다음 각호와 같다. (중략) |
| 6. 임상시험성적에 관한 자료 |
| 가. 일반사항 (중략) |
| 2) 외국자료의 경우 다음의 1에 해당하는 자료 |
| 가) 허가신청 당시 제출되어 평가된 임상시험성적자료로서 허가국 정부(허가 또는 등록 기관)가 제출받았거나 승인하였음을 확인한 것 또는 이를 공증한 자료 (하략) |
(4) 따라서 구 특허법 제89조 의 ‘허가 등을 위하여 필요한 활성ㆍ안전성 등의 시험’에는 외국 임상시험도 포함된다고 봄이 타당하고, 달리 국내 임상시험과 외국 임상시험을 차별할 합리적인 이유를 찾기 어렵다.
나) 2384 외국 임상시험이 이 사건 허가를 받기 위하여 필요하였는지 여부
갑 제9, 26, 33, 41, 42, 45호증의 각 기재에 변론 전체의 취지를 종합하여 인정되는 다음과 같은 사정에 비추어 보면, 비록 2384 외국 임상시험은 빌다글립틴 ‘단독투여’에 관한 것이지만 이 사건 허가에 있어 빌다글립틴의 ‘안전성 및 유효성’에 관한 자료로 검토되었으므로, 이 사건 품목허가를 받기 위하여 필요한 자료라고 봄이 타당하다.
(1) 2384 외국 임상시험 결과는 2007. 8. 9. 이 사건 2차 품목허가 신청 당시 ‘신청 효능효과에 대한 대조 임상시험’으로 제출된 자료로서(갑 제26호증), 2384 외국 임상결과보고서에는 다음과 같은 ‘빌다글립틴 (단독)투여군과 위약 투여군 사이의 이상반응(adverse event)’을 알아보는 시험 결과가 나타나 있다(갑 제9호증 4면).

| ‘24시간 치료 후 빌다글립틴(1일 1회 50mg, 1일 2회 50mg, 또는 1일 1회 100mg) 세 가지 용법ㆍ용량에서 비슷한 이상반응 프로파일을 갖는지 여부와 이러한 프로파일이 위약과 비슷한지를 보여줌으로써 제2형 당뇨병 환자에서 빌다글립틴이 안전하다는 것을 증명한다.’ |
(2) 식품의약품안전청 작성의 ‘안ㆍ유 심사결과서’에 다음과 같이 2384 외국 임상시험자료가 기재되어 있고 주6) (갑 제33호증) , 이 사건 허가 당시인 2007. 12. 28. 허가사항에도 2384 외국 임상시험에서의 빌다글립틴 ‘단독투여’에 관한 임상시험 결과가 검토된 내용이 구체적으로 기재되어 있다(갑 제41호증).
[안ㆍ유 심사결과서(갑 제33호증)]

[수입품목허가증(갑 제41호증)]

(중략)

(중략)

(3) 이 사건 품목허가증에는 “2,264명은 빌다글립틴을 단독으로 투여”받은 것으로 기재되어 있는데(갑 제41호증, 5면), 프랑스 최고보건청 자료에는 우리나라 허가사항에 언급된 ‘2,264명에는 2384 임상시험에 참여한 피험자가 포함된다.’는 내용이 기재되어 있다(갑 제42호증).

(4) 2384 외국 임상시험은 빌다글립틴의 단독투여에 관한 것이지만, 식품의약품안전평가원 발행『경구 혈당강하제 임상시험 가이드라인』(갑 제45호증)에는 ‘2.2.1. 단독요법 임상시험’이라는 항목에 “단독요법 임상시험에서 위약과 시험약의 비교는 허가받고자 하는 적응증이, 단독요법이든 병용요법이든 상관없이 새로운 혈당강하제의 혈당 강하 효과와 안전성 측면을 평가하기 위하여 필수적이다.”라고 기재되어 있다.
(5) 또한 ‘단독투여’나 ‘병용투여’나 모두 동일한 유효성분인 ‘빌다글립틴’의 ‘당뇨병 치료’에 관한 것이라는 점에서 서로 밀접한 관련성이 있다.
3) 피고들 주장에 대한 검토
가) 피고들은 원고가 이 사건 연장등록출원 당시 제출하거나 주장하지 않았던 ‘국내 임상시험 종료 후에도 2006. 7. 14.까지 외국 임상시험이 진행되었다는 사실’ 등을 새롭게 내세우며 이 사건 특허권 존속기간 연장등록의 유효를 주장하는 것은 위법하므로 허용될 수 없다고 주장한다.
살피건대, 앞서 본 바와 같이 통상실시권자인 한국노바티스는 이 사건 특허권 설정등록일인 2005. 8. 11.부터 수입품목허가를 받은 2007. 12. 28.까지의 기간에서 기ㆍ시 심사의뢰에 대한 자료보완 요청일 다음 날인 2006. 11. 18.부터 보완자료 제출일 전날인 2007. 1. 8.까지 52일과 안ㆍ유 심사의뢰에 대한 자료보완 요청일 다음 날인 2007. 10. 30.부터 보완자료 제출일 전날인 2007. 10. 31.까지 2일을 제외한 2년 2월 23일을 존속기간 연장기간으로 출원하여 등록받았다. 이에 피고들이 이러한 연장된 기간은 구 특허법 제89조 제1항 의 특허발명을 실시할 수 없었던 기간을 초과한다는 이유로 이 사건 등록무효심판을 청구하면서 기간 1에 대하여 원고에게 귀책사유가 있음을 주장하자, 원고가 이에 대한 방어방법으로 기간 1 동안에 2384 외국 임상시험의 진행으로 이 사건 특허발명을 실시할 수 없었다고 주장한 것이므로, 이러한 원고의 주장에 어떠한 위법이 있다고 볼 수 없다.
따라서 이 부분 피고들의 주장은 받아들이기 어렵다.
나) 피고들은 또한, 빌다글립틴의 위약대조 단독요법 시험은 2301과 2384의 2가지 시험이 존재하였고, 2301 시험만으로도 국내절차상 이 사건 특허를 실시하는 것에는 어떠한 법률적 장애도 없었으며, 차후에 2384 시험을 제출하였다고 할지라도 이 시험이 필수적이었다고 할 수는 없다고 주장한다.
살피건대, 앞서 본 바와 같이 2384 외국 임상시험 자료는 이 사건 품목허가에서 심사자료로 제출되었고, 이 사건 품목허가에 관한 안ㆍ유 심사결과서 및 수입품목허가증에 2384 외국 임상시험 결과가 모두 기재되어 있는 등 이 사건 품목허가에 있어 빌다글립틴의 ‘안전성 및 유효성’에 관한 자료로 검토되었으므로, 이 사건 품목허가를 받기 위하여 필요한 자료라고 봄이 타당하다.
따라서 이 부분 피고들의 주장도 받아들이기 어렵다.
4) 검토 결과
이상의 내용을 종합하여 보면, 기간 1은 특허권자인 원고에게 책임 있는 사유로 인하여 소요된 기간이라고 볼 수 없으므로, 이와 달리 판단한 이 사건 심결은 위법하다.
라. 기간 2에 관하여
1) 기간 2
허가권자는 2006. 6. 2. 1차 안ㆍ유 심사를 의뢰하였다가 2007. 3. 30. 이를 취하하였고, 다시금 2007. 5. 4. 2차 안ㆍ유 심사와 함께 1차 품목허가 신청을 하였다가 또다시 2007. 7. 31. 이를 취하하였으며, 2007. 8. 9. 3차 안ㆍ유 심사 및 2차 품목허가 신청에 의하여 2007. 12. 28. 비로소 수입의약품 품목허가를 취득하였다.
그런데 위 기간 중 기간 2는 DMF 신고필증 교부일 다음 날인 2007. 6. 15.부터 3차 안ㆍ유 심사 및 2차 품목허가 신청 전날인 2007. 8. 8.까지의 기간으로, 2차 안ㆍ유 심사 및 1차 품목허가 신청이 취하된 2007. 7. 31.을 기준으로 2007. 6. 15.부터 2007. 7. 31.까지의 ‘기간 2-①’과 2007. 8. 1.부터 2007. 8. 8.까지의 ‘기간 2-②’로 구분되고, 아래 [표]의 빨간색 표시 부분이다.
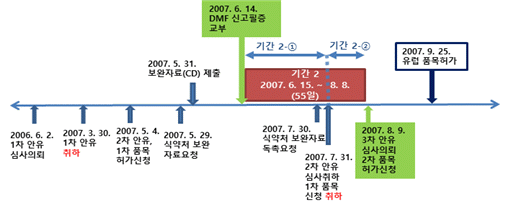
2) 귀책사유 유무
가) 이 사건 허가에 필요한 자료 제출의무
관련 법규에 의하면 수입의약품 품목허가를 위한 자료 제출 요건으로 생산국의 제조증명서 및 허가국 등의 판매증명서를 제출하도록 규정하고 있고( 구 약사법 시행규칙 제23조 제1항 ), 또한 수입의약품 품목허가를 위한 안ㆍ유 심사에는 식품의약품안전청에 제출한 ‘약리시험자료’ 및 ‘임상시험성적자료’가 ‘허가국 정부(허가 또는 등록 기관)가 제출받았거나 승인하였음’을 확인하거나 공증한 자료(식품의약품안전청 고시 제6조 제1항 제5호 및 제6호)를 제출하여야 한다고 규정하고 있다. 자세한 내용은 다음과 같다.
(1) 제조ㆍ판매증명서
구 약사법 제34조 제1항 의 위임에 따라 구 약사법 시행규칙 제23조 제1항 제1호 (마)목 에는, 이 사건 의약품과 같은 수입의약품이 허가를 받기 위해서는 ‘생산국의 정부 또는 공공기관에서 그 품목이 생산국의 법령에 적합하게 제조되고 있음을 증명하는 제조증명서’ 및 ‘허가 또는 등록국의 정부 또는 공공기관에서 그 품목이 그 국가의 법령에 적합하게 판매되고 있음을 증명하는 판매증명서’(이하 ‘제조ㆍ판매증명서’라 한다)를 제출해야 한다고 규정하고 있다.
| [구 약사법] |
| 제34조(의약품 등의 수입허가 등) |
| ① 의약품 등을 수입하고자 하는 자(이하 “수입자”라 한다)는 보건복지부령이 정하는 바에 의하여 품목마다 식품의약품안전청장의 허가를 받거나 신고를 하여야 한다. 허가받은 사항 또는 신고한 사항을 변경하고자 할 때에도 또한 같다. |
| [구 약사법 시행규칙] |
| 제23조(제조ㆍ수입품목의 허가신청 등) |
| ① 법 제26조 제1항 또는 법 제34조 제1항의 규정에 의하여 의약품 등의 품목허가를 받고자 하는 자는 [별지 제12호 서식]에 의한 신청서(전자문서로 된 신청서를 포함한다)에 다음 각호의 구분에 따른 서류(전자문서를 포함한다)를 첨부하여 식품의약품안전청장에게 제출하여야 한다. |
| 1. 의약품ㆍ의약외품 |
| 마. 수입품의 경우 다음에 해당하는 당해 품목의 제조 및 판매에 관한 서류. 이 경우 첨부서류의 요건 등에 관한 세부사항은 식품의약품안전청장이 고시하는 바에 의한다. |
| (1) 생산국의 정부 또는 공공기관에서 그 품목이 생산국의 법령에 적합하게 제조되고 있음을 증명하는 제조증명서 |
| (2) 허가 또는 등록국의 정부 또는 공공기관에서 그 품목이 그 국가의 법령에 적합하게 판매되고 있음을 증명하는 판매증명서 |
(2) 허가국이 확인ㆍ공증한 약리 및 임상시험자료
아래서 보는 바와 같이 구 약사법 제34조 제1항 , 동법 시행규칙 제27조 제1항 에 의하여 수입의약품 품목허가에 관한 사항을 순차 위임을 받은 식품의약품안전청 고시 제6조 제1항 제5호 및 제6호에 의하면, 이 사건 허가를 받기 위한 안ㆍ유 심사에는 식품의약품안전청에 제출한 ‘약리시험자료’ 및 ‘임상시험성적자료’가 ‘허가국 정부(허가 또는 등록 기관)가 제출받았거나 승인하였음을 확인한 것 또는 이를 공증한 자료’(이하 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’라 한다)를 제출해야 한다고 규정되어 있다.
| [구 약사법] |
| 제34조(의약품 등의 수입허가 등) |
| ① 의약품 등을 수입하고자 하는 자(이하 “수입자”라 한다)는 보건복지부령이 정하는 바에 의하여 품목마다 식품의약품안전청장의 허가를 받거나 신고를 하여야 한다. 허가받은 사항 또는 신고한 사항을 변경하고자 할 때에도 또한 같다. |
| [구 약사법 시행규칙] |
| 제27조(안전성ㆍ유효성의 심사) |
| ① 제23조 제1항, 법 제26조 제1항ㆍ제6항 및 제8항 또는 법 제34조 제1항ㆍ제4항 및 제5항의 규정에 의하여 의약품 등의 품목허가 또는 품목변경허가를 받거나 품목신고 또는 품목변경신고를 하고자 하는 자는 다음 각호의 자료(전자문서를 포함한다)를 갖추어 그 품목에 대한 안전성ㆍ유효성의 심사를 받아야 한다. 이 경우 심사대상품목, 자료작성요령, 각 자료의 요건 및 면제범위ㆍ심사기준 등에 관한 세부규정과 독성 및 약리작용 등에 관한 자료의 작성을 위하여 실시하는 비임상시험의 관리에 필요한 사항은 식품의약품안전청장이 정하는 바에 의한다. |
| (중략) |
| 5. 약리작용에 관한 자료 |
| 6. 임상시험성적에 관한 자료 |
| (이하 생략) |
| [식품의약품안전청 고시] |
| 제5조(의약품 등의 제출자료의 범위) |
| ① 의약품의 안전성ㆍ유효성 심사를 위하여 제출하여야 하는 자료의 종류는 다음 각호와 같으며, (이하 생략) |
| 제6조(제출자료의 요건) |
| ① 제5조 제1항 내지 제9항(주7)의 규정에 의한 자료의 요건은 다음 각호와 같다. |
| 5. 약리작용에 관한 자료 |
| 가. 일반사항 |
| 2) 당해 의약품의 허가국에서 허가신청 당시 제출되어 평가된 모든 약리시험자료로서 허가국 정부(허가 또는 등록 기관)가 제출받았거나 승인하였음을 확인한 것 또는 이를 공증한 자료 |
| 6. 임상시험성적에 관한 자료 |
| 가. 일반사항 |
| 2) 외국자료의 경우 다음의 1에 해당하는 자료 |
| 가) 허가신청 당시 제출되어 평가된 임상시험성적자료로서 허가국 정부(허가 또는 등록 기관)가 제출받았거나 승인하였음을 확인한 것 또는 이를 공증한 자료 |
① 제5조 제1항 내지 제9항 주7)
나) 식품의약품안전청의 자료보완 요청에 대한 자료 미제출 및 신청 취하
갑 제21, 22, 23, 24호증의 각 기재에 의하면 다음과 같은 사실을 인정할 수 있다.
(1) 식품의약품안전청은 한국노바티스의 2007. 5. 4. 2차 안ㆍ유 심사 및 1차 품목허가 신청과 관련하여, 2007. 5. 29. 다음과 같이 안전성, 유효성 보완요청 공문을 발송한 바 있고(갑 제21호증), 이에 대하여 한국노바티스는 기존에 제출된 자료 묶음 일체를 CD에 저장하여 위 보완요청일로부터 2일이 채 지나지 않은 2007. 5. 31. 안전성, 유효성 보완자료 CD를 제출하였다 주8) (갑 제22호증) .
| 〈붙임: 자료보완 요청사항〉 |
| ○ 의약품 등의 안전성ㆍ유효성 심사에 관한 규정(식품의약품안전청 고시 제2007-20호, 2007. 4. 5.)에 따라 다음의 자료를 제출하여 주시기 바랍니다. |
| 1. 제6조 제1항 제4호에 적합한 독성시험에 관한 자료. |
| 2. 제6조 제1항 제5호에 적합한 약리작용에 관한 자료. |
| 3. 제6조 제1항 제6호에 적합한 임상시험성적에 관한 자료. 끝. |
(2) 식품의약품안전청은 한국노바티스가 식품의약품안전청의 보완요청에 대하여 제대로 보완을 이행하지 않자, 2007. 7. 30. 다음과 같은 안전성, 유효성 보완자료 독촉공문을 발송하였고(갑 제24호증), 한국노바티스는 그 다음 날인 2007. 7. 31. 2차 안ㆍ유 심사 및 1차 품목허가 신청을 취하하였다.
| 〈붙임: 자료보완 요청사항〉 |
| 의약품 등의 안전성ㆍ유효성 심사에 관한 규정(식품의약품안전청 고시 제2007-20호, 2007. 4. 5.)에 따라 다음의 자료를 제출하여 주시기 바랍니다. |
| 1) 제6조 제1항 제5호 (가)목에 적합한 약리작용에 관한 자료 및 제6조 제1항 제6호 (가)목 2)에 적합한 임상시험성적에 관한 자료. |
| 2) 제6조 제1항 제5호에 적합한 DPP-Ⅳ 억제작용의 선택성을 증명하는 자료. |
| 3) 가교자료는 한국인 모집단 내 군 간 비교 등에 대한 자료를 중심으로 작성되어 민족 간의 차이를 판단하기 어려우므로, 전체 모집단, 비-한국인 및 비-아시아인과 한국인과의 비교를 중점적으로 재작성할 것. |
| 4) 가교자료 중 부록 “post text tables and figures”를 제출할 것. |
| 5) 제4조 제3항에 따라 제출자료 중 “Response to Korean Health Authority”에 대한 전체 번역문을 제출할 것. 끝. |
다) 허가권자의 귀책사유 및 상당인과관계
(1) 위 인정 사실에 의하여 알 수 있는 다음과 같은 사정들에 비추어 보면, 기간 2는 이 사건 안ㆍ유 심사 및 품목허가를 위하여 제출의무가 있는 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매허가서’가 구비될 때까지 만연히 지체된 기간으로, 이는 특허권자에게 책임 있는 사유로 인하여 소요된 기간이라고 할 것이고, 이러한 귀책사유와 허가 등의 지연 사이에 상당인과관계가 인정된다고 봄이 타당하다.
(가) 한국노바티스가 2차 안ㆍ유 심사에 대한 보완요청을 받고 보완자료로 제출한 CD에 관하여, 원고는 ‘기존에 제출된 자료 묶음 일체를 CD에 저장하여 2007. 5. 31. 제출하였다.’고 진술한 바 있고, 이러한 원고 진술에 의하면 한국노바티스는 2차 안ㆍ유 심사 및 1차 품목허가 신청 때 제출한 자료를 다시 제출한 것에 불과하므로, 식품의약품안전청의 보완요청에 대한 어떠한 보완도 이루어진 바가 없는 것으로 보인다.
(나) 식품의약품안전청이 2007. 5. 29. 한국노바티스에 발송한 안전성, 유효성 보완요청 공문에 기재된 ‘2. 제6조 제1항 제5호에 적합한 약리작용에 관한 자료. 3. 제6조 제1항 제6호에 적합한 임상시험성적에 관한 자료’에는 식품의약품안전청 고시에 살펴본 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 제출이 포함되어 있으나, 이에 대한 보완자료가 제출된 바 없다. 이에 식품의약품안전청은 2007. 7. 30. 위 안ㆍ유 심사와 관련하여 보완요청 사항을 구체적으로 특정하여 ‘제6조 제1항 제5호 (가)목에 적합한 약리작용에 관한 자료 및 제6조 제1항 제6호 (가)목 2)에 적합한 임상시험성적에 관한 자료’에 관한 자료보완 요청임을 명시하면서 보완사항을 추가하였고, 한국노바티스는 재차 보완을 요청받게 되자 2007. 7. 31. 위 신청을 취하하였다.
(다) 이 사건 허가에 필요한 자료인 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매증명서’는 외국의 품목허가를 받은 이후에나 제출 가능한 자료인데, 이 사건 의약품에 대한 유럽 품목허가는 2007. 12. 28.에 이루어졌으므로, 2차 안ㆍ유 심사 및 1차 품목허가 신청 당시인 2007. 5. 4. 그 제출 가능 여부가 불확실하였고, 위 신청을 취하한 2007. 7. 31.에도 유럽 품목허가가 이루어지지 않았다.
(라) 기간 2 이전에 이 사건 허가에 필요한 국내 임상시험은 2006. 1. 6., 그리고 외국 임상시험은 2006. 7. 14.에 이미 종료되었으므로(원고 주장의 외국 추가 임상시험을 고려하더라도 늦어도 2006. 8. 2. 모두 종료되었다), 2007. 7. 30.자 자료보완 요청사항 중 2) 내지 5)항은 보완기간 내에 해당 자료를 준비하여 제출할 수 있었을 것으로 보인다.
(마) 그렇다면 한국노바티스는 이 사건 안ㆍ유 심사 및 품목허가를 위하여 제출의무가 있는 자료인 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매허가서’의 제출 가능 여부가 불확실한 상태에서 2차 안ㆍ유 심사 및 1차 품목허가 신청을 하였고, 이에 관한 식품의약품안전청의 보완요청에도 이를 보완하여 제출할 수 없게 되자 그 신청을 취하한 것으로 보인다. 결국, 기간 2는 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매허가서’가 구비될 때까지 만연히 지체된 기간으로, 이는 특허권자에게 책임 있는 사유로 인하여 소요된 기간이라고 할 것이고, 이러한 귀책사유와 허가 등의 지연 사이에 상당인과관계가 인정된다고 할 것이다.
(2) 이와 관련하여 원고는, ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매증명서’를 확보하기 위하여 소요된 기간은 존속기간의 연장에 있어서 발명을 실시할 수 없었던 기간에 포함된다고 주장한다.
살피건대, ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매증명서’는 관련 법규에서 안ㆍ유 심사 및 품목허가를 위하여 허가신청인이 이를 제출할 의무가 있다고 규정하고 있는데, 이러한 자료의 제출 가능 여부가 불확실한 상태에서 안ㆍ유 심사 및 품목허가 신청을 하고, 이를 기간 내에 보완하여 제출할 수 없게 되어 위 신청을 취하한 것이라면 이는 허가권자의 귀책사유에 의해 소요된 기간으로 발명을 실시할 수 없었던 기간에 포함되지 않는다고 할 것이다. 나아가 이들 자료는 유럽 품목허가를 취득한 이후에나 제출할 수 있는 자료인데 앞서 본 바와 같이 유럽 품목허가 여부가 불확실한 주9) 상황에서 위 자료들이 제출될 때까지 만연히 지체된 기간까지 발명을 실시할 수 없었던 기간에 포함된다고 보기는 어렵다고 할 것이다.
따라서 원고의 위 주장은 받아들이기 어렵다.
3) 기간 2-①이 식품의약품안전청의 심사가 이루어진 기간으로 특허발명을 실시할 수 없었던 기간에 해당하는지 여부
다음과 같은 이유로 기간 2-①은 특허발명을 실시할 수 없었던 기간에 포함되지 않는다고 봄이 타당하다.
가) 기간 2-①은 DMF 신고필증 교부일 다음 날인 2007. 6. 15.부터 2차 안ㆍ유 심사 및 1차 품목허가 신청이 취하된 2007. 7. 31.까지의 기간이다. 이와 같은 취하 행위로 인하여 위 신청이 철회되어 심사 절차가 소멸되었다고 할 것이고, 2007. 8. 9. 3차 안ㆍ유 심사 및 2차 품목허가 신청에 의하여 2007. 12. 28. 이 사건 의약품에 관한 품목허가가 이루어졌으므로, 기간 2-①에 식품의약품안전청의 심사가 이루어졌다고 보기 어렵다.
이와 관련하여 원고는, 식품의약품안전청이 민원이력제 시행 이전부터 ‘취하, 반려 후 재신청’된 절차에 대하여 이전 심사와 연속성을 유지하여 왔으므로, 1차 품목허가 신청 취하 후 2차 품목허가를 신청하기까지의 기간은 그 연속성이 인정된다고 주장한다.
살피건대, 이 사건 허가 당시에 식품의약품안전청에서 취하ㆍ반려 후 재신청된 절차에 대하여 이전 심사와 연속성을 유지한 실무 관행이 있었다고 인정할 만한 객관적인 자료가 없다. 오히려 갑 제68, 69호증의 각 기재에 의하면, 이 사건 품목허가가 이루어진 이후인 2008. 5.경 비로소 일부 항목의 미비로 취하ㆍ반려된 후 재신청 시 종전 검토 결과를 인정하고 미비사항에 대해서만 검토하여 일관성을 유지하도록 하는 ‘허가ㆍ심사 민원이력제’가 도입ㆍ운영되었고, 그 후 2009. 6. 30. ‘의약품 등의 품목허가ㆍ신고ㆍ심사 규정’ 제55조의2에 민원이력제에 관한 규정이 신설된 사실, 위와 같은 민원이력제를 실시함에 있어서 민원이력카드를 작성하도록 하고 여기에 각 심사항목별로 제출자료의 유무, 검토 결과의 적합ㆍ부적합 여부를 기재하도록 하여 추후 다시 심사가 들어올 때 심사가 필요한 부분만을 추가 검토하여 허가 여부를 심사하도록 한 사실이 인정된다.
그렇다면 이 사건 허가는 허가ㆍ심사 민원이력제가 도입ㆍ운영되기 이전에 품목허가된 주10) 것이고 , 달리 이전 심사와 연속성이 유지된다고 볼 만한 사정도 없으므로, 이 부분 원고의 주장은 받아들이기 어렵다(한편 원고는 이 사건 연장등록출원에 있어서 2006. 11. 18.부터 2007. 1. 8.까지의 기간을 연장기간에서 제외한 바 있는데, 이 기간은 취하된 1차 안ㆍ유 심사가 진행되고 있었던 기간이므로 원고 주장에 의하면 이 또한 2, 3차 안ㆍ유 심사와의 연속성이 인정되어 이를 제외할 필요가 전혀 없었음에도 스스로 이를 연장기간에서 제외한 바 있다).
나) 설령 원고의 주장과 같이 1차 품목허가 신청 취하 후 2차 품목허가를 신청하기까지의 기간의 연속성이 인정되더라도, 앞서 본 바와 같이 기간 2는 이 사건 안ㆍ유 심사 및 품목허가를 위하여 제출의무가 있는 ‘허가국이 확인ㆍ공증한 약리 및 임상시험자료’ 및 ‘제조ㆍ판매허가서’가 구비될 때까지 만연히 지체된 기간으로, 식품의약품안전청에서 이 사건 안ㆍ유 심사 및 품목허가에 관한 실질적인 심사가 이루어졌다고 볼 수 없으므로, 어느 모로 보나 원고의 위 주장은 받아들이기 어렵다.
4) 원고 주장에 대한 검토
가) 원고는 2000년 특허청 고시가 적용된 심사사례 8건은 한 건의 예외 없이 모두 ‘임상시험계획서 승인일 또는 특허권등록일 중 늦은 날로부터 의약품 허가일까지의 전체 기간’을 연장기간으로 인정해 주었으므로, 이는 재량준칙이 되풀이 시행되어 행정관행이 되었다고 할 것이어서 이를 준수하지 않는 것은 재량권 일탈ㆍ남용에 해당하고, 2000년 특허청 고시에 의한 기대이익은 보호되어야 한다고 주장한다.
살피건대, 갑 제37호증의 기재에 의하면, 국내 임상시험을 실시한 사례 중 2000년 특허청 고시가 적용된 사례가 8건 있었고, 위 8건 사례에서 모두 ‘임상시험계획서 승인일 또는 특허권등록일 중 늦은 날로부터 의약품 허가일까지의 전체 기간’이 연장된 사실은 인정된다. 그런데 위 8건의 사례는 위 전체 기간 내에서 특허권자의 귀책사유 여부가 다투어지지 않았던 사안이므로, 2000년 특허청 고시가 특허권자의 귀책사유를 고려함이 없이 위 전체 기간에 대하여 존속기간 연장을 인정한 것이라고 보기는 어렵다. 또한 위와 같은 8건의 사례만으로 귀책사유의 고려 없이 임상시험계획서 승인일 또는 특허권등록일 중 늦은 날로부터 의약품 허가일까지의 전체 기간을 인정하는 것이 행정관행이라고 보기도 어렵다.
따라서 ‘임상시험계획서 승인일 또는 특허권등록일 중 늦은 날로부터 의약품 허가일까지의 전체 기간’에서 특허권자의 귀책사유가 인정되는 기간을 제외하는 것이 재량권 일탈ㆍ남용에 해당한다거나 2000년 특허청 고시에 의한 기대이익에 반한다고 볼 수 없으므로, 이 부분 원고의 주장은 받아들이기 어렵다.
나) 원고는 기간 2 동안 2384 외국 임상시험 및 2303E1, 2304E1, 2305E1, 2309E1 외국 추가 임상시험에 관한 자료를 정리하고 이에 관한 보고서를 작성하였으므로 이는 발명을 실시할 수 없었던 기간에 해당하고, 또한 2384 외국 임상시험 자료는 2007. 5.경 전달받았으므로 기간 2 이전에 해당 자료를 검토할 수 없었다는 취지로 주장한다.
살피건대, 2384 외국 임상시험을 제외한 나머지 2303E1, 2304E1, 2305E1, 2309E1 외국 추가 임상시험 자료는 이 사건 품목허가에 필요한 자료라고 인정할 만한 증거가 없고, 또한 이러한 임상시험에 관한 자료를 정리하고 준비하는 데 소요된 기간이 당연히 특허발명을 실시할 수 없었던 기간에 포함된다고 보기도 어렵다.
설령 이러한 기간을 고려한다고 하더라도 2384 외국 임상시험의 종료일인 2006. 7. 14.부터 또는 위 임상시험에서 종료일이 가장 늦은 2304E1 외국 추가 임상시험의 종료일인 2006. 7. 28.부터 각각 기간 2가 시작되는 2007. 6. 15. 이전까지 약 11개월의 기간 동안 충분히 이에 관한 자료를 정리하고 준비할 수 있었을 것으로 보이므로, 기간 2가 이를 준비하는 데 필요한 기간이라고 보기도 어렵다. 또한 2384 외국 임상시험 자료는 한국노바티스가 원고 측으로부터 쉽게 입수할 수 있는 자료이므로 이를 늦게 전달받은 불가피한 사정이 있다고 보기도 어렵다.
따라서 이 부분 원고의 주장도 받아들이기 어렵다.
다) 또한 원고는, ① 구 약사법, 동법 시행령 및 시행규칙 어디에도 제조ㆍ판매증명서를 첨부하지 않은 품목허가신청서를 반려 대상으로 규정하고 있지 않고, ② ‘한국의약품허가제도’ 자료(갑 제63호증)에서는 제조ㆍ판매증명서를 “신청 당시에 제출하기 어려운 경우에는 당해 심사기한 내에 제출할 수 있다.”라고 기재하고 있으며, ③ 2008년 제정된 “의약품 등의 품목허가ㆍ신고ㆍ심사 규정”의 제4조 제4항에 “신청 당시에 제출하기 어려운 경우에는 당해 신청민원의 처리기한 내 제출할 수 있다.”라고 규정하였고, ④ 세계 각국 제조ㆍ판매증명서 제출 현황에 관한 연구 논문(갑 제64호증)에서는 우리나라를 품목허가 신청 이후 제조ㆍ판매증명서를 제출할 수 있는 국가로 소개하고 있으므로, 제조ㆍ판매증명서의 제출은 허가 ‘신청’을 위한 요건이 아닌, ‘허가’ 요건에 해당한다고 주장한다.
살피건대, 갑 제63, 64, 70호증의 각 기재에 의하면 이 사건 품목허가 신청 당시 제조ㆍ판매증명서를 제출하지 않더라도 당해 심사기한 내에 이를 제출하는 것이 실무상 허용되고 있었던 사정은 인정된다.
그러나 구 약사법 시행규칙 제23조 제1항 은 의약품 등의 품목허가를 받고자 하는 자는 제조ㆍ판매증명서를 첨부하여 품목허가신청서를 식품의약품안전청장에게 제출하여야 한다고 규정하고 있고, 식품의약품안전청으로부터 제조ㆍ판매증명서 제출에 관한 보완요청을 받고 보완기간 내에 이를 제출하지 않는 경우 품목허가 신청이 반려될 수 있음은 앞서 본 바와 같다. 그리고 허가권자가 제조ㆍ판매증명서를 신청 당시 제출하지 않더라도 품목허가 신청을 바로 반려하지 않는 것은 의약품 수입이 늦어지지 않도록 하기 위하여 허가권자의 편의를 고려한 것일 뿐, 이를 이유로 존속기간 연장에서 위 제조ㆍ판매증명서를 확보할 때까지의 기간까지 산정되어야 한다고 보기는 어렵다. 또한 제조ㆍ판매증명서는 외국 품목허가를 받아야만 제출 가능한 자료인데, 외국 품목허가를 받을 수 있을지, 그리고 언제 외국 품목허가가 이루어질지 불확실한 상황에서 이 사건 품목허가를 신청하였다는 사정만으로 만연히 이를 제출할 때까지 절차를 지연시키는 것은 타당하지 않다.
따라서 특허발명을 실시할 수 없었던 기간에 위 제조ㆍ판매증명서를 확보할 때까지의 기간이 포함된다고 보기 어렵다고 할 것이므로, 이 부분 원고의 주장도 받아들이기 어렵다.
5) 검토 결과
이상의 내용을 종합하여 보면, 기간 2는 특허권자인 원고에게 책임 있는 사유로 인하여 소요된 기간이라고 할 것이므로, 이 부분 심결의 판단은 적법하다.
마. 기타 피고들의 주장에 대한 판단
피고들은 2007. 11. 1.부터 2007. 11. 26. 사이에 안ㆍ유 심사가 종료되어 수입품목허가부서에 협의회신되었다면 협의회신일 이후부터 2007. 11. 26.까지의 기간은 관련 부서의 어떠한 심사도 이루어지지 않은 기간이므로 무효라고 주장한다.
살피건대, 피고들 주장과 같이 2007. 11. 1.부터 2007. 11. 26. 사이에 안ㆍ유 심사에 관한 협의회신이 있었다고 하더라도, 그때부터 안ㆍ유 심사결과의 타당성 및 최종적인 품목허가에 대한 서류검토 업무가 진행된다고 보아야 하고, 나아가 특허발명을 실시할 수 없는 기간의 종기는 약사법 등에 의한 허가 등의 처분이 그 신청인에게 도달함으로써 그 처분의 효력이 발생한 날까지라는 점을 고려한다면, 피고들 주장의 위 기간 역시 특허발명 등을 실시할 수 없었던 기간에 해당된다고 봄이 타당하다.
따라서 이 부분 피고들의 주장은 받아들이기 어렵다.
4. 결론
그러므로 이 사건 심결취소소송은 기간 2에 대한 취소를 구하는 부분은 이유 없으나, 기간 1에 대한 취소를 구하는 부분은 이유 있어 이를 인용하는 이상, 연장등록된 기간 전체에 영향을 미치게 되므로 모두 함께 취소하여 특허심판원으로 하여금 구 특허법 제134조 제3항 에 따라 이 사건 특허발명을 실시할 수 없었던 기간을 초과하여 연장된 기간에 대하여만 연장등록을 무효로 하는 심결을 하도록 하는 것이 타당하다. 결국 이 사건 심결은 전부 취소되어야 한다.
따라서 이 사건 심결의 취소를 구하는 원고의 청구는 이유 있으므로 이를 인용하되, 실질적으로 원고가 일부 패소하였으므로 소송비용의 부담에 관하여는 민사소송법 제98조 , 제101조 를 적용하여, 주문과 같이 판결한다.
주1) 의약품 기준 및 시험방법 심사는 의약품 품목의 제조와 품질관리를 위한 기준[예컨대 성상, 순도, 함량, 정량법, 특수시험(소화력, 미생물시험) 등)] 및 이를 확인하기 위한 구체적인 시험방법이 정해져 있는지를 심사하는 것이다. 이하 ‘기ㆍ시 심사’라 한다.
주2) 안전성ㆍ유효성 심사는 허가 대상 의약품에 관한 임상시험 결과, 독성, 약리작용 등 안전성과 유효성을 심사하는 것이다. 이하 ‘안ㆍ유 심사’라 한다.
주3) 원료의약품 정보(Drug Master File)는 원료의약품에 대한 정보, 즉 원료의약품에 대한 해당 원료 제조소의 시설 내역, 불순물, 잔류유기용매, 공정관리, 포장재질, 안정성 시험자료 등을 의미하며, 원료의약품 정보 심사는 위와 같은 사항들을 평가하는 것이다. 이하 ‘DMF 심사’라 한다.
주4) 수입품목허가증 교부일은 수입품목허가증(갑 제41호증)이 신청인에게 도달한 날을 의미한다.
주5) 관련 법리에 기재된 구 특허법(2014. 6. 11. 법률 제12753호로 개정되기 전의 것) 제89조 제1항, 제2항은 이 사건에서 적용된 구 특허법 제89조, 제91조 제1항 제3호, 제2항 규정과 같은 취지이다.
주6) 이 사건 허가에 관련된 부분은 검은색 표기 부분이다(파란색 및 빨간색 표기 부분은 다른 허가사항에 관한 것으로 추가된 부분이다).
주7) 의약품 등의 제출자료의 범위를 규정하고 있다.
주8) 2020. 8. 20.자 원고 준비서면 20면 참조
주9) 이 사건 의약품에 대하여 2006. 3.경 미국에서도 품목허가를 신청한 바 있으나, 미국에서는 품목허가를 취득하지 못하였다.
주10) 원고도 이 사건 품목허가는 민원이력제 시행 이전에 이루어졌으므로 민원이력카드가 작성되지 않았다는 점에 대하여서는 인정하고 있다.