판시사항
갑 연구소가 명칭을 “COVID-19 항원용 단백질, 이를 코딩하는 DNA 단편 및 이를 포함한 유전자 백신”으로 하는 발명을 출원하였다가 특허청 심사 도중 2차례에 걸쳐 청구항 삭제나 정정 등으로 보정을 하였는데, 특허청 심사관이 재심사에서도 진보성이 부정된다며 출원발명에 대하여 특허거절결정을 하고, 특허심판원도 재심사 거절결정에 대한 불복심판청구에서 진보성이 부정된다는 이유로 심판청구를 기각하는 심결을 하자, 갑 연구소가 특허청장을 상대로 심결의 취소를 구하는 소를 제기한 사안에서, 출원발명의 청구항 2 발명은 ‘히말라야 원숭이에서 SARS-CoV-2에 대한 DNA 백신 보호’라는 제목으로 반포된 논문인 선행발명과 기술분야 및 발명의 목적이 공통되고, 그 구성요소를 대비하면 공통점과 함께 차이점도 몇 가지 있으나 이러한 차이점은 통상의 기술자가 선행발명들을 결합하여 쉽게 극복할 수 있으며, 선행발명들에서 예측할 수 없는 현저한 효과를 가진다고 인정할 수도 없으므로, 진보성이 부정되어 특허를 받을 수 없고, 특허출원에서 청구범위가 둘 이상의 청구항으로 이루어진 경우 어느 한 청구항에라도 거절이유가 있으면 출원이 일체로서 거절되어야 하므로, 출원발명은 나머지 청구항에 관하여 살펴볼 필요 없이 모두 특허를 받을 수 없다고 한 사례
판결요지
갑 연구소가 명칭을 “COVID-19 항원용 단백질, 이를 코딩하는 DNA 단편 및 이를 포함한 유전자 백신”으로 하는 발명을 출원하였다가 특허청 심사 도중 2차례에 걸쳐 청구항 삭제나 정정 등으로 보정을 하였는데, 특허청 심사관이 재심사에서도 진보성이 부정된다며 출원발명에 대하여 특허거절결정을 하고, 특허심판원도 재심사 거절결정에 대한 불복심판청구에서 진보성이 부정된다는 이유로 심판청구를 기각하는 심결을 하자, 갑 연구소가 특허청장을 상대로 심결의 취소를 구하는 소를 제기한 사안이다.
출원발명의 청구항 2에는 “서열번호 4의 유전자 서열로 이루어지고, COVID-19 항원용 단백질을 코딩하는 COVID-19 유전자 백신용 DNA 단편으로서, 상기 COVID-19 항원용 단백질은 Y449A, N487A, Q493A, N501G, Y505G, R683G, R685G, R815G, K986P 및 V987P로 치환되며, 상기 유전자 서열은 CMV 프로모터, Kozak 서열, IgM signal 펩타이드 서열, 표적 항원, BGH poly(A) tail 및 연속적인 2개의 SV40 인핸서의 순서로 배열된 재조합 벡터에 표적 항원으로 포함되고, 상기 재조합 벡터는 COVID-19 유전자 백신용 조성물에 포함되는 것을 특징으로 하는, COVID-19 유전자 백신용 DNA 단편(이하 ‘제2항 발명’이라 한다)”이라고 기재되어 있는데, 제2항 발명이 보호받으려는 사항은 ‘(서열번호 4의 유전자 서열로 이루어진, COVID-19 유전자 백신용) DNA 단편’이고, 외래 유전물질을 인위적으로 운반할 때 사용되는 DNA 분자인 벡터를 형질전환(transformation) 등 유전자 재조합(genetic recombination)에 의하여 제조하였음을 의미하는 ‘재조합 벡터(recombinant vector)’ 부분은 제2항 발명으로 보호받으려는 ‘DNA 단편’을 어떤 방법으로 유전자 백신으로 쓰는지에 관한 용법을 기재한 것에 불과할 뿐 ‘DNA 단편’ 자체의 제조방법이 아니어서 제2항 발명의 기술적 구성요소라고 볼 수 없으므로, 제2항 발명의 청구범위는 ‘서열번호 4의 유전자 서열로 이루어진, Y449A, N487A, Q493A, N501G, Y505G, R683G, R685G, R815G, K986P 및 V987P로 치환된 (COVID-19 항원용 단백질을 코딩하는 COVID-19 유전자 백신용) DNA 단편’이라고 해석함이 타당하다고 한 다음, SARS-CoV-2(COVID-19) 스파이크 단백질 아미노산 치환을 통해 항원용 단백질을 코딩하는 유전자 백신용 DNA 단편을 제공함에 목적이 있는 제2항 발명은, SARS-CoV-2 스파이크 단백질의 여섯 종류 변이체인 프로토타입 DNA 백신 후보군을 개발하고, 히말라야 원숭이에 대한 공격 후 방어 시험(challenge)을 통해 그 후보들의 면역원성과 보호효능을 평가하기 위하여 ‘히말라야 원숭이에서 SARS-CoV-2에 대한 DNA 백신 보호’라는 제목으로 반포된 논문인 선행발명 1과 기술분야 및 발명의 목적이 공통되는데, 위 청구범위 해석을 바탕으로 제2항 발명의 구성요소에 대응되는 선행발명 1의 구성요소를 대비하면 공통점과 함께 차이점도 몇 가지 있으나 이러한 차이점은 통상의 기술자가 선행발명 1에 선행발명 2(온라인에 공개된 ‘변이가 숙주세포 수용체 ACE2를 가진 인간 SARS-CoV-2의 수용체 결합 도메인 구조, 기능, 역학에 미치는 영향’이라는 제목의 논문), 선행발명 3(온라인에 공개된 ‘SARS-CoV-2에 의한 수용체 인식의 구조적 기반’이라는 제목의 논문)을 결합하여 쉽게 극복할 수 있고, 제2항 발명이 선행발명들에서는 예측할 수 없는 현저한 효과를 가진다고 인정할 수도 없으므로, 제2항 발명은 진보성이 부정되어 특허를 받을 수 없고, 특허출원에서 청구범위가 둘 이상의 청구항으로 이루어진 경우 어느 한 청구항에라도 거절이유가 있으면 출원이 일체로서 거절되어야 하므로, 출원발명은 나머지 청구항에 관하여 살펴볼 필요 없이 모두 특허를 받을 수 없다고 한 사례이다.
원고
국방과학연구소 (소송대리인 특허법인(유한) 대아 담당변리사 박지은 외 1인)
피고
특허청장
2023. 3. 16.
주문
1. 원고의 청구를 기각한다.
2. 소송비용은 원고가 부담한다.
특허심판원이 2022. 2. 24. 2021원3203호 사건에 관하여 한 심결 을 취소한다.
이유
1. 기초 사실
가. 이 사건 출원발명(갑 제2, 6, 18호증)
1) 발명의 명칭: COVID-19 항원용 단백질, 이를 코딩하는 DNA 단편 및 이를 포함한 유전자 백신
2) 원출원의 출원일/원출원번호/분할출원일/분할출원번호: 2020. 11. 12./(원출원번호 생략)/2021. 3. 18./(분할출원번호 생략)
3) 청구범위(2021. 10. 18. 자 보정에 의한 것)
【청구항 1】(삭제) 주1)
【청구항 2】서열번호 4의 유전자 서열로 이루어지고, COVID-19 항원용 단백질을 코딩하는 COVID-19 유전자 백신용 DNA 단편으로서,
상기 COVID-19 항원용 단백질은 Y449A, 주2) N487A, Q493A, N501G, Y505G, R683G, R685G, R815G, K986P 및 V987P로 치환되며,
상기 유전자 서열은 CMV 프로모터, Kozak 서열, IgM signal 펩타이드 서열, 표적 항원, BGH poly(A) tail 및 연속적인 2개의 SV40 인핸서의 순서로 배열된 재조합 벡터에 표적 항원으로 포함되고,
상기 재조합 벡터는 COVID-19 유전자 백신용 조성물에 포함되는 것을 특징으로 하는, COVID-19 유전자 백신용 DNA 단편(이하 ‘이 사건 제2항 발명’이라 한다).
【청구항 3】서열번호 4의 유전자 서열로 이루어지고, COVID-19 항원용 단백질을 코딩하는 COVID-19 유전자 백신용 DNA 단편을 포함하는 재조합 벡터로서,
상기 COVID-19 항원용 단백질은 Y449A, N487A, Q493A, N501G, Y505G, R683G, R685G, R815G, K986P 및 V987P로 치환되며,
상기 유전자 서열을 표적 항원으로 하고, CMV 프로모터, Kozak 서열, IgM signal 펩타이드 서열, 표적 항원, BGH poly(A) tail 및 연속적인 2개의 SV40 인핸서의 순서로 배열된 것을 특징으로 하는, 재조합 벡터.
【청구항 4, 5】(각 삭제) 주3)
【청구항 6 내지 9】(이 사건에서 구체적으로 살피지 않으므로 기재를 생략한다)
4) 이 사건 출원발명의 주요 내용은 [별지 1], 서열번호 4는 [별지 2] 기재와 같다.
나. 선행기술
1) 선행발명 1(갑 제7, 10, 12, 13호증, 을 제1, 6, 7, 9호증)
2020. 8. 14. 반포된 선행발명 1은 ‘히말라야 원숭이에서 SARS-CoV-2에 대한 DNA 백신 보호’라는 제목의 논문으로, 주4) 그 주요 내용은 [별지 3-1] 기재와 같다.
선행발명 1에는 2016. 3. 2. 공개된 ‘인간 코로나바이러스 스파이크 단백질의 융합 전 구조’라는 제목의 논문, 주5) 2017. 8. 14. 온라인 공개된 ‘합리적으로 설계된 융합 전 MERS-CoV 스파이크 항원의 면역원성(면역원성, immunogenicity) 및 구조’라는 제목의 논문, 주6) 2020. 2. 19. 반포된 ‘전 융합 형태의 2019-nCoV 스파이크 초저온 전자현미경 구조’라는 제목의 논문 주7) 이 인용되어 있다(이하 선행발명 1의 인용번호에 따라 순서대로 ‘참고문헌 11, 12, 13’이라 한다). 각 참고문헌의 주요 내용은 [별지 3-2] 기재와 같다.
2) 선행발명 2(갑 제8호증, 을 제2호증)
2020. 8. 7. 온라인 공개된 선행발명 2는 ‘변이가 숙주세포 수용체 ACE2를 가진 인간 SARS-CoV-2의 수용체 결합 도메인 구조, 기능, 역학에 미치는 영향’이라는 제목의 논문으로, 주8) 그 주요 내용은 [별지 4] 기재와 같다.
ACE2(Angiotensin-Converting Enzyme 2)는 호흡기 등의 상피세포에 존재하는 효소수용체로, SARS-CoV-2가 숙주세포의 표면에 잘 달라붙게 하여 바이러스의 세포 침투능력을 높여준다.
3) 선행발명 3(갑 제9호증, 을 제3호증)
2020. 3. 30. 온라인 공개된 선행발명 3은 ‘SARS-CoV-2에 의한 수용체 인식의 구조적 기반’이라는 제목의 논문으로, 주9) 그 주요 내용은 [별지 5] 기재와 같다.
다. 이 사건 심결 경위
1) 특허청 심사관은 2021. 5. 24. 원고에게, ‘이 사건 출원발명의 청구항 1 내지 9는 그 발명이 속하는 기술분야에서 통상의 지식을 가진 사람(이하 ‘통상의 기술자’라 한다)이 선행발명 1, 2, 3을 결합하여 쉽게 발명할 수 있으므로 특허법 제29조 제2항 에 따라 진보성이 부정되어 특허를 받을 수 없다.’는 이유로 의견제출통지를 하였다.
2) 원고는 2021. 7. 22. 이 사건 출원발명의 청구항 1을 삭제하고, 청구항 2 내지 9를 정정하였으나, 특허청 심사관은 2021. 9. 17. ‘이 사건 출원발명의 보정된 청구항 2 내지 9는 선행발명 1, 2, 3의 결합에 의해 진보성이 부정되므로 거절이유가 해소되지 않았다.’는 이유로 이 사건 출원발명에 대하여 특허거절결정을 하였다.
3) 원고는 2021. 10. 18. 이 사건 출원발명의 청구항 2에 보정 전 청구항 5와 9의 구성을 인용하여 한정하고, 청구항 3에 청구항 5의 구성을 병합하고, 그에 따라 보정 전 청구항 4, 5를 삭제하는 등으로 정정하는 보정을 하여 재심사를 청구하였다. 그러나 특허청 심사관은 2021. 11. 18. ‘보정된 청구항들을 재심사한 결과 여전히 선행발명 1, 2, 3의 결합에 의해 진보성이 부정되어 거절이유가 해소되지 않았다.’는 이유로 이 사건 출원발명의 청구항 2, 3, 6 내지 9에 대하여 특허거절결정을 하였다.
4) 원고는 2021. 12. 17. 특허심판원에 위 재심사 거절결정에 대한 불복심판을 청구하였고( 2021원3203 ), 특허심판원은 2022. 2. 24. ‘이 사건 출원발명은 통상의 기술자가 선행발명 1, 2, 3의 결합으로부터 쉽게 생각하여 예측해 낼 수 있는 정도여서 진보성이 부정된다.’는 이유로 원고의 심판청구를 기각하는 이 사건 심결을 하였다.
[인정 근거] 다툼 없는 사실, 갑 제1 내지 13, 18호증, 을 제1, 2, 3, 6, 7, 9, 27호증 각 기재(가지번호 있는 것은 각 가지번호 포함, 이하 같다), 변론 전체 취지
2. 당사자 주장의 요지
가. 원고
1) 이 사건 제2항 발명 중 ‘COVID-19 항원용 단백질이 Y449A, N487A, Q493A, N501G, Y505G, R683G, R685G, R815G, K986P, V987P로 치환’되는 구성은 선행발명 1, 2, 3에 제시되거나 암시되어 있지 아니하다. 즉, 스파이크 단백질의 ① 수용체-결합 영역(Receptor-Binding Domain; RBD) 중 493번 위치 글루타민(Q)을 알라닌(A)으로, 501, 505번 위치의 아스파라긴(N), 티로신(Y)을 글라이신(G)으로 치환하는 구성, ② S1/S2 퓨린(furin) 절단 부위 중 683, 685번 위치만 선택해 아르기닌(R)을 글라이신(G)으로 치환하는 구성, ③ S2’ 절단 부위인 815번 위치의 잔기를 치환하는 구성에 관한 기재나 암시가 없다.
2) 이 사건 제2항 발명에서 “(상기 유전자 서열은) CMV 프로모터, Kozak 서열, IgM signal 펩타이드 서열, 표적 항원, BGH poly(A) tail 및 연속 2개의 SV40 인핸서의 순서로 배열된 재조합 벡터에 표적 항원으로 포함되고, 상기 재조합 벡터는 COVID-19 유전자 백신용 조성물에 포함되는 것을 특징으로 하는” 부분(이하 ‘이 사건 재조합 벡터 부분’이라 한다)은 이 사건 제2항 발명의 기술적 구성요소에 해당한다. 이러한 구성은 선행발명 1, 2, 3에 제시되거나 암시되어 있지 않고, 원고 특허 (특허번호 생략)(갑 제13호증, 이하 ‘원고 관련 특허’라 한다)로 등록되어 이미 진보성을 인정받은 바 있다.
3) 이 사건 제2항 발명은 통상의 기술자가 선행발명 1, 2, 3을 결합하여 쉽게 생각해 낼 수 없고, 선행발명에서 예측할 수 없는 현저한 효과를 가지므로, 진보성이 부정되지 아니한다.
나. 피고
1) 이 사건 제2항 발명은 ‘DNA 단편’에 관한 발명이고, 이것이 표적 항원으로 포함되는 재조합 벡터에 관한 기재는 DNA 단편 자체의 기술적 구성요소라 볼 수 없다.
2) 선행발명 1과 그 참고문헌에 S1/S2 퓨린 절단 부위(682~686번)의 아르기닌(R)이 글라이신(G)으로 변이·치환되는 구성, S’ 절단 부위(815번)의 위치가 개시되어 있고, 선행발명 2, 3에 RBD 중 449, 487, 493, 501, 505번 위치의 잔기를 치환하는 구성이 개시 또는 암시되어 있다. 변이가 필요하다고 인식된 부위의 아미노산 잔기를 구조가 간단한 비극성 아미노산인 알라닌(A)이나 글라이신(G)으로 바꾸는 것은 통상적 시도에 불과하다.
3) 이 사건 제2항 발명에 선행발명에서 예측할 수 없는 현저한 효과가 있다고 볼 수도 없다. 결국 이 사건 제2항 발명은 통상의 기술자가 선행발명 1, 2, 3을 결합하여 쉽게 발명할 수 있으므로 진보성이 부정된다.
3. 이 사건 심결의 위법 여부
가. 관련 법리
어느 특허발명의 청구범위에 기재된 청구항이 복수의 구성요소로 되어 있는 경우는 각 구성요소가 유기적으로 결합한 전체로서의 기술사상이 진보성 판단의 대상이 되는 것이지 각 구성요소가 독립하여 진보성 판단 대상이 되는 것은 아니므로, 그 특허발명의 진보성을 판단할 때는 청구항에 기재된 복수의 구성을 분해한 후 분해된 개별 구성요소들이 공지된 것인지만 따져서는 안 되고, 특유의 과제 해결원리에 기초해 유기적으로 결합된 전체로서 구성의 곤란성을 따져야 하며, 이때 결합된 전체 구성으로서의 발명이 갖는 특유한 효과도 함께 고려하여야 한다.
그리고 여러 선행기술문헌을 인용하여 특허발명의 진보성을 판단할 때는 인용되는 기술을 조합 또는 결합하면 그 특허발명에 이를 수 있다는 암시, 동기 등이 선행기술문헌에 제시되어 있거나 그렇지 않더라도 특허발명 출원 당시의 기술수준, 기술상식, 그 기술분야의 기본적 과제, 발전경향, 업계의 요구 등에 비추어 통상의 기술자가 쉽게 그러한 결합에 이를 수 있다고 인정할 수 있으면 해당 특허발명의 진보성이 부정된다( 대법원 2007. 9. 6. 선고 2005후3284 판결 참조).
나. 이 사건 제2항 발명의 청구범위 해석
원고는 이 사건 재조합 벡터 부분이 이 사건 제2항 발명의 기술적 구성요소라고 주장한다. 그러나 앞서 인정한 사실, 앞서 든 증거 및 변론 전체 취지로 알 수 있는 다음 사정에 비추어 보면, 이 사건 재조합 벡터 부분은 이 사건 제2항 발명의 기술적 구성요소라고 볼 수 없다.
1) 이 사건 제2항 발명이 보호받으려는 사항은 ‘(서열번호 4의 유전자 서열로 이루어진, COVID-19 유전자 백신용) DNA 단편’이다.
2) 여기서 ‘벡터(vector)’는 외래 유전물질을 인위적으로 운반할 때 사용되는 DNA 분자로, 플라스미드, 박테리오파지, 바이러스 등이 사용된다(원고 관련 특허 식별번호 [0003, 0006] 참조). ‘재조합 벡터(recombinant vector)’란 형질전환(transformation) 등 유전자 재조합(genetic recombination)에 의하여 그러한 벡터를 제조하였음을 의미한다(원고 관련 특허 식별번호 [0042]). 운반체인 벡터는 거기에 삽입해 운반하려고 하는 유전물질(유전자 백신용 항원 유전자 등)과는 구별된다.
3) 원고 관련 특허는 “순차적으로 배열된 CMV 프로모터, Kozak 서열, IgM signal 펩타이드 서열, 표적 항원 및 BGH poly(A) tail 서열; 및 1개 또는 2개의 SV40 인핸서 서열;을 포함하고, 상기 SV40 인핸서 서열은, BGH poly(A) tail 뒤에 1개 위치하거나, CMV 프로모터 앞에 연속적으로 2개 또는 BGH poly(A) tail 뒤에 연속적으로 2개 위치하거나, 또는 CMV 프로모터 앞과 BGH poly(A) tail 뒤에 각각 1개 위치하는 것인, 유전자 백신용 항원 유전자를 전달하기 위한, 발현 벡터”(청구항 제1항) 등을 청구범위로 한다. 여기서 “표적 항원” 부분에는 무엇에 대한 백신을 만들려고 하는지에 따라 다른 항원이 들어갈 수 있다. 병원체 항원분자일 수 있고, 원고 관련 특허에서는 위 벡터에 ‘탄저균 D4 항원’을 삽입한 예를 들었다(원고 관련 특허 식별번호 [0016, 0022, 0072]). [그림 1](원고 관련 특허 도면 3 마지막 그림)은 표적 항원(붉은 색 화살표 “D4” 부분)이 재조합 벡터에 삽입되는 위치를 표현한 모식도이다.
[그림 1] 표적 항원의 재조합 벡터 삽입 위치(갑 제13호증)
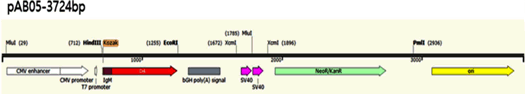
4) 이 사건 제2항 발명이 바로 “표적 항원” 자리에 들어갈 ‘DNA 단편’에 해당한다. 이 사건 재조합 벡터 부분은 원고 관련 특허의 기술구성을 모두 가지고 있으므로, 이 사건 제2항 발명은 원고 관련 특허를 이용하는 것이라고 볼 수 있다. 위 모식도에서 “표적 항원” 자리에 ‘탄저균 D4 항원’ 대신 ‘서열번호 4의 유전자 서열’을 삽입한다는 점이 다를 뿐이다. 원고 관련 특허는 “표적 항원” 자리에 다른 항원이 들어갈 수 있음을 예정하고 있었다(그런데 원고는 서열번호 4의 유전자 서열을 삽입한 ‘재조합 벡터’까지 별도로 이 사건 출원발명의 청구항 3항으로 청구하고 있다).
5) 이 사건 재조합 벡터 부분은 이 사건 제2항 발명으로 보호받으려고 하는 ‘DNA 단편’을 어떤 방법으로 유전자 백신으로 쓰는지에 관한 용법을 기재한 것에 불과하다. 원고는 ‘이 사건 재조합 벡터 부분이 제조방법을 기재한 것이고, 그로 인해 DNA 단편의 침투효과를 강화하는 효과가 있다.’고 주장한다. 그러나 원고도 인정하는 바와 같이 그것이 ‘DNA 단편’ 자체의 제조방법이라 볼 수 없을 뿐 아니라, 그로써 ‘DNA 단편’의 구조, 즉 서열번호 4의 유전자 서열이 변경되지도 아니하므로, 이 사건 재조합 벡터 부분은 이 사건 제2항 발명의 대상인 ‘DNA 단편’ 자체를 한정하는 기술적 구성요소라고 볼 수 없다(원고와 피고가 언급하지는 않았지만 이 사건 제2항 발명에서 “COVID-19 항원용 단백질을 코딩하는 COVID-19 유전자 백신용”이라는 부분도 위 ‘DNA 단편’의 용도를 기재한 것에 불과하다).
따라서 이 사건 제2항 발명의 청구범위는, ‘서열번호 4의 유전자 서열로 이루어진, Y449A, N487A, Q493A, N501G, Y505G, R683G, R685G, R815G, K986P 및 V987P로 치환된 (COVID-19 항원용 단백질을 코딩하는 COVID-19 유전자 백신용) DNA 단편’이라고 해석함이 타당하다.
다. 이 사건 제2항 발명과 선행발명 1의 구성요소 대비
이 사건 제2항 발명은 SARS-CoV-2(COVID-19) 주10) 스파이크 단백질 아미노산 치환을 통해 항원용 단백질을 코딩하는 유전자 백신용 DNA 단편을 제공함에 목적이 있는 발명이다[이 사건 출원발명 최종 명세서(이하 ‘최종 명세서’라 한다) 식별번호 [0001, 0007, 0011] 참조]. 선행발명 1은 SARS-CoV-2 스파이크 단백질의 여섯 종류 변이체인 프로토타입 DNA 백신 후보군을 개발하고, 히말라야 원숭이에 대한 공격 후 방어 시험(challenge)을 통해 그 후보들의 면역원성과 보호효능을 평가하기 위한 논문이다(논문 806쪽). 따라서 기술분야와 발명의 목적이 공통된다.
앞서 본 바와 같은 청구범위 해석을 바탕으로, 이 사건 제2항 발명의 구성요소에 대응되는 선행발명 1의 구성요소를 대비하면 다음 표와 같다.

라. 공통점과 차이점 분석
1) 공통점
선행발명 1이 유전자 서열을 모두 기재하고 있지 않은 반면, 이 사건 제2항 발명의 구성요소 1은 DNA 단편의 유전자 서열을 서열번호 4로 구체적으로 제시하고 있다. 그러나 이는 SARS-CoV-2 스파이크 단백질의 아미노산 일부를 구성요소 2 기재처럼 치환한 것인바(최종 명세서 식별번호 [0043, 0049]), 그 치환된 부분 중 뒤에서 보는 차이점을 제외한 나머지 서열은 공통된다(K986P, V987P 치환도 공통 주11) ). SARS-CoV-2의 유전자 서열은 2020. 2.경 공개되었고, 주12) 전 세계 과학자들이 그 직후부터 이를 토대로 많은 연구결과를 내놓기 시작하였음은 여러 사람이 두루 아는 사실이다.
2) 차이점 1
이 사건 제2항 발명의 구성요소 2 중 Y449A, N487A, Q493A, N501G, Y505G로 치환하는 구성은 선행발명 1에 개시되어 있지 않다(이하 ‘차이점 1’이라 한다).
3) 차이점 2
이 사건 제2항 발명은 구성요소 2에서 S1/S2 퓨린 절단 부위를 R683G, R685G로 치환했는데, 선행발명 1의 변이체 S.dTM.PP(후술)는 퓨린 절단 부위를 삭제한 점, 참고문헌 13은 682, 684번 위치까지 치환하고 683, 685번 위치 아르기닌(R)을 [글라이신(G)이 아닌] 세린(S)으로 치환했다는 점에서 차이가 있다(이하 ‘차이점 2’라 한다).
4) 차이점 3
이 사건 제2항 발명의 구성요소 2 중 S2’ 절단 부위에서 R815G로 치환하는 구성은 선행발명 1에 개시되어 있지 않다(이하 ‘차이점 3’이라 한다).
마. 차이점 검토
1) 차이점 1
앞서 인정한 사실, 앞서 든 증거, 을 제12, 13, 21 내지 24호증 각 기재 및 변론 전체 취지를 종합하여 알 수 있는 다음 사정에 비추어 보면, 차이점 1은 통상의 기술자가 선행발명 1에 선행발명 2, 3을 결합하여 쉽게 극복할 수 있다.
① 선행발명 2는 SARS-CoV-2에 대항하는 약물개발을 위한 기초자료로서 SARS-CoV-2 수용체 결합의 구조적 기초에 관한 정보를 제공하기 위한 논문이고, 선행발명 3은 SARS-CoV-2 수용체 인식을 목표로 하는 중재(intervention) 전략을 위한 지침을 제공하고자 SARS-CoV-2, SARS-CoV, RaTG13 사이에 ACE2와 결합 친화도를 비교한 논문이다. 위 논문들은 스파이크 단백질에 의해 매개되는 바이러스 진입 단계에서, ACE2와 결합하는 부분인 RBD 중 수용체-결합 모티프(Receptor-Binding Motif; RBM) 잔기의 변이가 ACE2 결합력을 낮출 수 있음을 보여주고 있다. 선행발명 2, 3도 기술분야 및 발명의 목적이 이 사건 제2항 발명, 선행발명 1과 일부 공통된다.
② 선행발명 2에는 RBM 일부를 Y449A, N487A, Y489A, N501A, Y505A로 치환하는 구성이 ACE2의 결합 강도를 교란한다는 점, 493번 위치가 수용체 결합에 관여한다는 점 주13) 이 개시되어 있다. 선행발명 3에는 Q493N, Q493Y, N501T로의 변이가 ACE2 결합 친화도를 낮춘다는 것이 개시되어 있다.
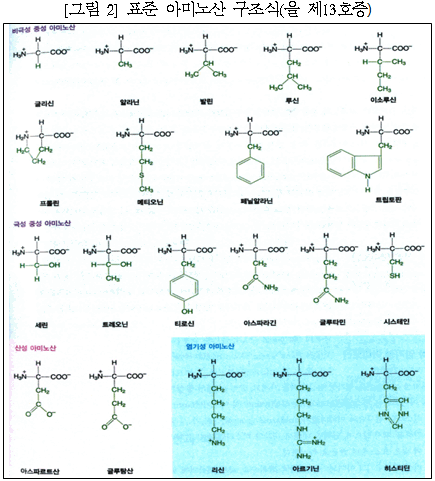
차이점 1 중 Y449A, N487A는 선행발명 2에 완전히 개시되어 있다. 나머지 Q493A, N501G, Y505G와 관련하여, 선행발명 2, 3에서는 493번 위치의 글루타민(Q)이 [알라닌(A)이 아닌] 아스파라긴(N), 티로신(Y)으로, 501, 505번 위치의 아스파라긴(N), 티로신(Y)이 [글라이신(G)이 아닌] 알라닌(A), 트레오닌(T)으로 각 치환·변이된 점이 다르나, 이 사건 제2항 발명이 채택한 글라이신(G), 알라닌(A)은 아미노산 중 구조가 가장 간단한 비극성 아미노산에 해당하여 통상의 기술자가 가장 먼저, 쉽게 고려할 수 있는 선택지에 속한다([그림 2] 참조). 주14)
③ 이 사건 출원발명 원출원일 이전에 특정 위치의 아미노산에 돌연변이를 유발하여 알라닌으로 치환하는 방법인 알라닌 스캐닝이, 위 발명이 속한 미생물학, 분자생물학 등 기술분야에서 널리 행해지고 있었다[을 제12호증(1997년 논문), 을 제21호증 참조]. 단백질 복합체를 형성할 때 각 도메인의 기능을 방해하지 않으면서 유연한 링커를 제공하기 위해 글라이신을 도입할 수 있다는 것도 2012년경 이미 알려져 있었다(을 제22, 23호증).
원고는 ‘449, 487, 493, 501, 505, 683, 685, 815번 위치까지 총 여덟 군데, 또는 그보다 많은 잔기를 알라닌(A)이나 글라이신(G)으로 치환하는 조합은 256개(= 28) 이상이므로, 그중 뛰어난 1개 조합을 선택하는 것이 쉽지 않다.’고 주장한다. 그러나 이 사건 출원발명 당시 알라닌 스캐닝 등 아미노산 잔기를 쉽게 치환하는 방법이 보편화되어 있었던 이상 여러 조합으로 치환을 시도하는 것이 특별히 곤란했다고 볼 수 없다.
④ SARS-CoV-2 수용체와 밀접하게 상호작용하는 RBM의 위치가 449, 487, 493, 501, 505번으로 알려진 이상 통상의 기술자라면 해당 위치 잔기부터 치환하려 시도할 것이고, 주15) 알라닌(A) 또는 글라이신(G)으로 치환을 먼저 고려할 것이다. 따라서 차이점 1은 통상의 기술자의 일반적인 창작능력 범위 내에 있어 기술적 어려움이 없다.
2) 차이점 2
앞서 인정한 사실, 앞서 든 증거 및 변론 전체 취지를 종합하여 알 수 있는 다음 사정에 비추어 보면, 차이점 2는 통상의 기술자가 쉽게 극복할 수 있다.
① 선행발명 1에는 S.dTM.PP(퓨린 절단 부위 삭제, 두 개의 프롤린 치환, 주16) 폴돈 삼량체 태그를 한, 융합 전 안정화된 가용성 세포외도메인) 주17) 의 경우, 퓨린 절단 부위 돌연변이로 인해 분비 단백질의 가수분해 절단(proteolytic cleavage)이 일어나지 않은 것으로 추정된다는 기재가 있고, 백신이 효과적으로 기능하려면 그와 같은 안정화가 중요하다는 취지의 기재가 있다. 참고문헌 12에는 바이러스가 RBD에서는 쉽게 항체-회피 돌연변이를 만들 수 있어 융합 전 안정화된 S 단백질 세포외도메인의 생산능력이 중요할 것이라는 내용이 있다. 이 사건 출원발명 원출원일 전인 2020. 9. 28. 공개된 논문(을 제24호증) 주18) 에는 안정화 치환, 즉 퓨린 절단 부위의 변이와 S2의 경첩 영역(hinge region)에 있는 연속 두 개의 프롤린이 중화항체가를 높인다는 내용이 있다.
참고문헌 11에는 퓨린 절단 부위의 752 내지 756번 위치 RRKRR을 GGSGS로 치환하는 구성, 주19) 참고문헌 12에는 퓨린 절단 부위의 748 내지 751번 위치 RSVR을 ASVG로 치환하는 구성, 참고문헌 13에는 퓨린 절단 부위 중 682 내지 685번 위치의 아미노산 잔기를 GSAS로 치환하는 구성 등이 개시되어 있다. 즉, 원고가 시도한 683, 685번 위치의 치환이 개시되어 있다.
② 원고는 ‘퓨린 절단 부위의 683, 685번 위치가 항원 안정성 확보에 가장 중요하다고 판단하였기 때문에 두 곳만 치환하였고, 선행발명 1 등에는 특정 위치가 다른 위치보다 더 중요하다는 기재나 암시가 없다.’고 주장한다. 그러나 이 사건 출원발명의 명세서 어디에도 683, 685번 위치의 치환이 항원의 안정성에 영향을 미친다는 내용이 없고, 그러한 효과가 확인되지도 아니한다.
그렇다면 잔기 치환의 후보로 알려진 위치 중 일부만 글라이신(G)으로 치환하는 것은, 통상의 기술자가 구체적인 개시나 암시가 없더라도 쉽게 시도할 수 있는 범위 내에 있다.
③ 원고는 ‘선행발명 어디에도 RBM 부위 치환과 퓨린 절단 부위 치환의 결합에 관한 기재나 암시가 없다.’고도 주장한다. 그러나 위에서 본 바와 같이 RBD에서는 쉽게 면역 회피 돌연변이가 생길 수 있어 퓨린 절단 부위 및 프롤린 치환을 통한 안정화가 중요하다는 내용이 이미 개시되어 있다. 선행발명 2, 3에 실시례나 실험데이터가 없다는 것만으로 결합의 동기가 없다고 볼 수도 없다.
3) 차이점 3
앞서 인정한 사실, 앞서 든 증거, 을 제5, 10, 11, 25호증의 각 기재 및 변론 전체 취지를 종합하여 알 수 있는 다음 사정에 비추어 보면, 차이점 3은 통상의 기술자가 쉽게 극복할 수 있다.
① 참고문헌 11은 HKU1 바이러스의 901 내지 918 위치에 인접한 2차 절단 부위로서 S2’에 관하여 언급하면서, 도면 6[그림 3]에서 SARS-CoV, MER-CoV의 대응되는 위치를 표시하고 있다.
[그림 3] 참고문헌 11, S2’ 절단 부위(갑 제10호증, 을 제6호증)
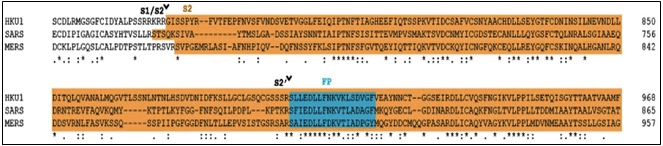
참고문헌 13의 도면 1. A.[그림 4]와, 이 사건 출원발명 원출원일 전인 2020. 6. 2. 온라인 공개된 논문(을 제5호증) 주20) 의 도면 3. A. B.[그림 5]도 S2’ 절단 부위 위치를 표시하고 있다.
[그림 4] 참고문헌 13, S2’ 절단 부위(갑 제12호증, 을 제7호증)
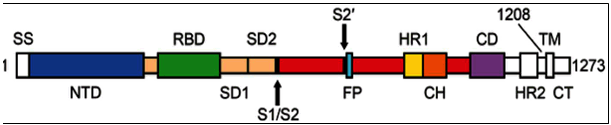
[그림 5] Lockman et al., S2’ 절단 부위(을 제5호증)
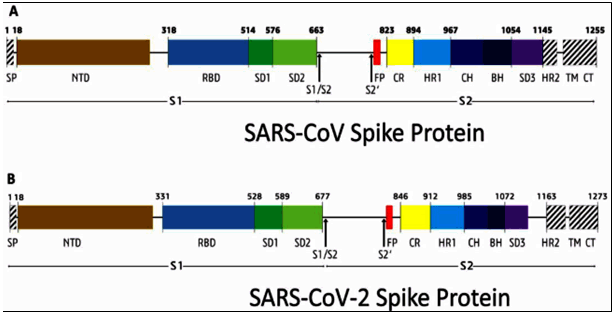
그리고 이 사건 출원발명 원출원일 전에 반포된 여러 문헌에, SARS-CoV-2가 세포 내로 침투할 때 “S2’(R815 위치) 절단”은 S1/S2 절단이 있은 후 일어나는 것으로 보이고, 원형질막에서 숙주-수용체 결합이 일어나거나 바이러스의 세포 내 이입(endocytosis)이 있기까지는 일어나지 않을 수 있다는 점이 개시되어 있었다(을 제6, 9, 10, 11호증). 주21) S2’ 절단에 관여하는 TMPRSS2(transmembrane serine protease 2) 억제제와 S1/S2 절단에 관여하는 퓨린 억제제 MI-1851을 결합하면 SARS-CoV-2에 대하여 더 강력한 항바이러스 활성이 만들어진다는 것도 알려져 있었다(을 제25호증). 주22)
② 따라서 통상의 기술자는 S1/S2 퓨린 절단 부위와 함께 S2’ 절단 부위 치환을 시도해 볼 것이고, 글라이신(G)으로의 치환은 앞에서 본 바와 같이 통상의 기술자의 일반적인 창작능력 범위 내에 있는 것으로 기술적 어려움이 없다.
③ 이에 대하여 원고는, “참고문헌 12가 S2’ 절단 부위의 치환은 불필요하거나 S1/S2 절단 부위에 비해 그 필요성이 낮음을 암시하고 있다.”라고 주장한다.
참고문헌 12 중 원고가 근거로 든 부분은 “단백질 생합성 중에 퓨린이 S1/S2 부위에는 접근할 수 있는 반면, S2’ 부위에는 접근할 수 없는 이유가 아직 밝혀지지는 않았다. (...) 우리 구조에서 R887(Arg887)과 S888(Ser888) 사이의 펩타이드 결합은 프로테아제에 접근할 수 없는 상태로 남아 있고, 이는 융합 과정에 S2의 형태변화가 일어나기 전까지는 S2’가 효율적으로 절단될 수 없음을 시사한다.”라는 부분이다(7351쪽). 그런데 위 내용은 S2의 형태변화가 일어난 뒤에야 S2’가 효율적으로 절단될 수 있다는 의미, 즉 앞서 본 다른 문헌들처럼 S2’ 절단은 S1/S2 절단이 있은 후 순차적으로 일어난다는 뜻이고, S2’ 절단 부위의 치환 필요성이 없거나 적다는 의미로 해석될 수 없다.
4) 결합의 용이성
앞에서 본 바와 같이 선행발명 1과 선행발명 2, 3은 기술분야와 발명의 목적이 공통되고, 선행기술문헌에 차이점 1, 2, 3에 관한 기재나 암시가 있어 통상의 기술자는 이를 쉽게 극복하고 이 사건 제2항 발명과 같이 8개 아미노산 잔기를 치환하는 구성에 이를 수 있다. 선행발명들에 이러한 조합을 방해하는 부정적인 교시가 있지도 않다.
5) 효과 대비
원고는 ‘이 사건 제2항 발명에는 선행발명 1, 2, 3에서는 예측할 수 없는 현저한 효과가 있다.’고 주장하면서, ‘이 사건 제2항 발명은 야생형 S 단백질보다 항체가가 약 10배 높게 나타났고, 1:2560 희석배율까지 중화능을 보였으며, 1:40 희석배율까지 95~100% 세포생존율을 나타냈다.’는 비교실험결과를 제시한다. ‘이 사건 제2항 발명의 항체가가 선행발명 1보다 500배 높다.’고도 주장한다.
그러나 앞서 인정한 사실, 앞서 든 증거, 갑 제14, 15호증, 을 제4호증 각 기재 및 변론 전체 취지를 종합하여 알 수 있는 다음 사정에 비추어 보면, 원고가 제출한 증거만으로는 이 사건 제2항 발명이 선행발명들에서는 예측할 수 없는 현저한 효과를 가진다고 인정할 수 없다.
① 원고가 비교실험에서 대조군으로 삼은 야생형 단백질(wtCoV) 아미노산 서열을 보면 986, 987번 위치의 아미노산이 각각 라이신(K)과 발린(V)이다.
그런데 참고문헌 13에는 986, 987번 위치 아미노산을 프롤린(P)으로 치환하는 데 더해 퓨린 절단 부위를 치환한 구성이 개시되어 있고, 여러 선행기술문헌에 이러한 안정화가 중화항체 형성을 높인다는 점이 개시되어 있다. 원고가 이 사건 제2항 발명의 현저한 효과를 보이려면 프롤린 치환 등 선행발명들에 개시된 부분은 같은 조건으로 놓고 대조한 실험결과를 제시했어야 한다. 예컨대, 선행발명 1의 S.dTM.PP와 대비하여 효과가 우수하다는 점이 증명되어야 한다.
② 이 사건 제2항 발명과 선행발명 1의 효과를 직접 비교할 자료도 부족하다.
이 사건 제2항 발명은 골든 햄스터를 대상으로 실험하였고, 선행발명 1의 실험(도면 1B, 2D)은 히말라야 원숭이에 대한 것으로서 종차가 존재한다. 그런데 히말라야 원숭이는 비인간 영장류로서 인간에 가장 근접한 우수한 모델이라는 평가를 받고 있다(을 제4호증 83쪽). 또한 선행발명 1은 신속한 평가를 위해 프로토타입 DNA 백신으로 실험한 것으로서, 운반체로 pcDNA3.1+ 벡터를 사용하였는바, 이 사건 제2항 발명의 실험에서와 재조합 벡터 구성에 차이가 있다. 그러나 앞서 본 것처럼 이 사건 재조합 벡터 부분은 이 사건 제2항 발명의 기술적 구성요소라 볼 수 없으므로, 효과의 현저성을 판단할 때도 재조합 벡터의 조건을 같게 놓고 비교하여야 한다.
③ 결국 원고가 제시한 자료는 이 사건 제2항 발명이 선행발명들보다 현저한 효과를 갖는지 파악하기에 적합하지 않다.
바. 소결론
이 사건 제2항 발명은 진보성이 부정되어 특허를 받을 수 없다. 특허출원에서 청구범위가 둘 이상 청구항으로 이루어진 경우 어느 한 청구항에라도 거절이유가 있으면 그 출원은 일체로서 거절되어야 한다. 그렇다면 이 사건 출원발명은 나머지 청구항에 관하여 더 나아가 살펴볼 필요 없이 모두 특허를 받을 수 없다.
4. 결론
원고의 심판청구를 기각한 이 사건 심결은 적법하므로, 이 사건 심결 취소를 구하는 원고의 청구는 이유 없어 기각한다.
[별 지 1] 이 사건 출원발명의 주요 내용: 생략
[별 지 2] 서열번호 4: 생략
[별 지 3-1] 선행발명 1의 주요 내용: 생략
[별 지 3-2] 참고문헌 11, 12, 13의 주요 내용: 생략
[별 지 4] 선행발명 2의 주요 내용: 생략
[별 지 5] 선행발명 3의 주요 내용: 생략
주1) 삭제 전【청구항 1】은 “서열번호 1의 아미노산 서열을 포함하는 것을 특징으로 하는, COVID-19 항원용 단백질”이었다.
주2) 야생형(wild type) 단백질의 449번 아미노산 잔기가 티로신(Y)에서 알라닌(A)으로 치환되었다는 의미이다. 한편 DNA를 구성하는 네 가지 염기-아데닌〈A〉, 구아닌〈G〉, 시토신〈C〉, 티민〈T〉[RNA는 우라실〈U〉]-가 세 개 모이면 아미노산이 되는데, 이를 ‘코돈(codon)’이라 한다. 20여 개 아미노산이 각각 하나 이상의 코돈에 의해 지정된다. 예를 들어, 알라닌(A)은 GCT, GCC, GCA, GCG 코돈에 의해 지정되고, 글라이신(G)은 GGT, GGC, GGA, GGG 코돈에 의해 지정된다.
주3) 위 삭제 전 청구항 2 내지 5는 다음과 같다.【청구항 2】서열번호 4의 유전자 서열로 이루어지고, COVID-19 항원용 단백질을 코딩하는 것을 특징으로 하는, DNA 단편.【청구항 3】서열번호 4의 유전자 서열로 이루어진 DNA 단편을 포함하는 것을 특징으로 하는, 재조합 벡터.【청구항 4】제3항에 있어서, 상기 유전자 서열을 표적 항원으로 하고, CMV 프로모터, 표적 항원, BGH poly(A) tail, 연속적인 2개의 SV40 인핸서의 순서로 배열된 것을 특징으로 하는, 재조합 벡터.【청구항 5】제4항에 있어서, CMV 프로모터와 표적 항원 사이에 Kozak 서열 및 IgM signal 펩타이드 서열을 더 포함하는 것을 특징으로 하는, 재조합 벡터.
주4) Jingyou Yu et al., “DNA vaccine protection against SARS-CoV-2 in rhesus macaques”, Science 369(6505), 806-811 (2020). 온라인 공개일은 2020. 5. 20.인 것으로 보인다.
주5) Robert N. Kirchdoerfer et al. “Pre-fusion structure of a human coronavirus spike protein”, Nature 531, 118-121 (2016).
주6) Jesper Pallesen et al. “Immunogenicity and structures of a rationally designed prefusion MERS-CoV spike antigen”, PNAS 114(35), E7348-7357 (2017). 간행일은 2017. 8. 29.
주7) Daniel Wrapp et al. “Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation”, Science 367(6438), 1260-1263 (2020).
주8) Budheswar Dehury et al., “Effect of mutation on structure, function and dynamics of receptor binding domain of human SARS-CoV-2 with host cell receptor ACE2: a molecular dynamics simulations study”, Journal of Biomolecular Structure and Dynamics 39(18), 7231-7245 (2021).
주9) Jian Shang et al., “Structural basis of receptor recognition by SARS-CoV-2”, Nature 581, 221-224 (2020). 간행일은 2020. 5. 14.
주10) COVID-19는 세계보건기구(WHO)가 SARS-CoV-2(사스코로나바이러스-2)에 의한 ‘질병’에 붙인 이름이다.
주11) 참고문헌 12 도면 1. A 및 참고문헌 13 ‘Supplementary Materials’ 부분 참조.
주12) Roujian Lu et al., “Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding”, Lancet 395, 565-574 (2020) 등.
주13) 3쪽 도면 1. A.의 β9 아래 ★ 부분 “Q”가 순서상 493번 위치에 해당한다. 9쪽 Table 2.에도 명시되어 있다.
주14) 원고도 이 사건 출원발명이 속한 기술분야에서 ‘아미노산 치환 부위의 결합력을 저해시키기 위한 목적으로 아미노산을 치환할 때는 주로 알라닌(A)과 글라이신(G)을 사용한다.’는 점을 다투지 아니한다(2022. 9. 26. 자 준비서면 8쪽).
주15) 선행발명 3은 493, 455, 501번 위치 잔기가, 수용체 인식에 중요한 ‘핫스팟(hotspot)’의 안정화에 관여함을 개시하고 있다(223쪽, 도면 2a).
주16) 앞서 본 K986P, V987P 치환으로, 구성요소 대비표 그림의 S.dTM.PP 중간에 두 줄 빨간 선으로 표시한 부분에 해당한다.
주17) “prefusion-stabilized soluble ectodomain with deletion of the furin cleavage site, two proline mutations, and a foldon trimerization tag”를 줄여 S.dTM.PP로 표시한 것이다.
주18) Rinke Bos et al., “Ad26 vector-based COVID-19 vaccine encoding a prefusion-stabilized SARS-CoV-2 Spike immunogen induces potent humoral and cellular immune responses”, npj Vaccines 5, 91 (2020).
주19) 원고는 참고문헌 11이 COVID-19 전의 코로나 바이러스에 관한 연구라고 지적한다(2022. 4. 18. 자 준비서면 10쪽). 그러나 참고문헌 11의 저자들이 ‘(HKU1 바이러스에 관한) 우리 연구는 SARS-CoV, MERS-CoV 등 다른 베타코로나바이러스 일반에도 적용될 수 있다.’고 쓰고 있는 것처럼(120쪽 왼쪽 하단), 같은 계통 코로나바이러스 사이에는 상동성이 높아서 통상의 기술자가 참고문헌 11을 기초로도 퓨린 절단 부위의 중요성을 충분히 인식할 수 있다고 봄이 타당하다. 선행발명 2에도 ‘지난 6개월 동안 RCSB PDB(단백질 데이터 뱅크) 등에 보고된 구조 데이터는 SARS-CoV-2 RBD와 SARS-CoV RBD가 거의 같은 결합면을 공유한다는 이전의 발견을 뒷받침한다.’는 기재가 있다(2쪽 왼쪽 중간 부분). SARS-CoV와 SARS-CoV-2의 스파이크 단백질을 비교한 [그림 5]도 참조.
주20) Syed Mohammad Lokman et al., “Exploring the genomic and proteomic variations of SARS-CoV-2 spike glycoprotein: A computational biology approach”, Infection, Genetics and Evolution (2020).
주21) 2020. 9. 17. 온라인 공개된 Donald J. Benton et al., “Receptor binding and priming of the spike protein of SARS-CoV-2 for membrane fusion”, Nature 588, 327-330 (을 제10호증); 2020. 10. 5. 온라인 공개된 Canrong Wu et al., “Furin: A potential therapeutic target for COVID-19”, iScience 23 (을 제11호증).
주22) 2020. 7. 23. 온라인 공개된 Dorothea Bestle et al., “TMPRSS2 and furin are both essential for proteolytic activation of SARS-CoV-2 in human airway cells”, Life Science Alliance 23 (2020).
참조조문
본문참조판례
특허심판원이 2022. 2. 24. 2021원3203호 사건에 관하여 한 심결
2021원3203
대법원 2007. 9. 6. 선고 2005후3284 판결
본문참조조문
